Электрохимическая коррозия металла – это процесс, в результате которого металл подвергается разрушению под действием химических реакций с окружающей средой. Это явление является одной из основных причин повреждения и разрушения металлических конструкций, трубопроводов, оборудования и других изделий.
Процесс электрохимической коррозии основан на принципе электрического потенциала, который заключается в том, что разные металлы имеют различные электрохимические свойства. При контакте металла с окружающей средой, создается электрохимическая реакция, включающая окисление и восстановление электронов, что приводит к образованию ионов металла и ионов окружающей среды.
Коррозия происходит, когда на металлической поверхности образуется анод и катод. Анод – это область, где происходит окисление металла и выделение электронов. Катод – это область, где ионы окружающей среды принимают электроны и происходит восстановление. В результате этого процесса металл постепенно разрушается и теряет свои свойства и прочность.
Коррозия может быть вызвана различными факторами, такими как влажность, температура, кислотность окружающей среды, химические реакции и другие. Она может происходить на поверхности металла или внутри его структуры, что делает ее еще более опасной и разрушительной.
Для предотвращения электрохимической коррозии металлов можно применять различные методы, такие как применение защитных покрытий, антикоррозионных материалов, использование анодных защитных систем и других специальных технологий. Однако, принимая во внимание различные факторы, необходимо разработать индивидуальную стратегию защиты для каждого конкретного случая, чтобы минимизировать электрохимическую коррозию и продлить срок службы металлических изделий.
Что такое электрохимическая коррозия

Электрохимическая коррозия - это процесс разрушения металла, обусловленный его взаимодействием с окружающей средой под воздействием электролита и электрического тока.
В основе электрохимической коррозии лежит электрохимическая реакция между металлом, окружающими его веществами и электролитом. При этом происходит перенос электронов от металла к веществам окружающей среды, что приводит к разрушению металла.
Процесс электрохимической коррозии может иметь различные причины и механизмы. Например, коррозия может происходить из-за воздействия влаги, кислот, солей или других химически активных веществ. Также важную роль играют различия в потенциалах и концентрациях растворенных веществ на поверхности металла, что создает условия для возникновения электрохимических реакций.
Электрохимическая коррозия может приводить к значительному разрушению металла и особенно опасна в технических системах, таких как трубопроводы, судовые конструкции, автомобили и другие. Борьба с коррозией требует применения специальных защитных покрытий, использования коррозионностойких материалов и мониторинга состояния металлических конструкций.
Принцип электрохимической коррозии

Электрохимическая коррозия - это процесс разрушения металла под действием химических реакций, вызванных электрическими потенциалами на его поверхности. Она возникает в результате взаимодействия металла с окружающей его средой, особенно под влиянием воды, кислот, солей и кислорода.
Принцип электрохимической коррозии основан на том, что металл имеет свою электрическую разность потенциалов. На его поверхности происходят окислительно-восстановительные реакции, обусловленные присутствием растворенных веществ или различных содержащихся компонентов.
В процессе электрохимической коррозии металл оказывается в условии электрической ячейки, в которой он играет роль одного из электродов. На его поверхности может образоваться анод и катод, через которые проходит ток. В результате коррозии металл переходит в растворяемую форму и погруженная вещество вступает в реакцию с окружающей средой.
Принцип электрохимической коррозии базируется на разности потенциалов между разными участками поверхности металла. Эта разность возникает из-за различной концентрации растворенных веществ или разных условий окружающей среды на разных участках. На поверхности металла происходят окислительные и восстановительные реакции, а сами металлы действуют как электроды, через которые переносятся электроны.
Таким образом, принцип электрохимической коррозии основан на взаимодействии различных химических компонентов на поверхности металла и создании электрической разности потенциалов, вызывающей окислительно-восстановительные процессы.
Процесс электрохимической коррозии металла
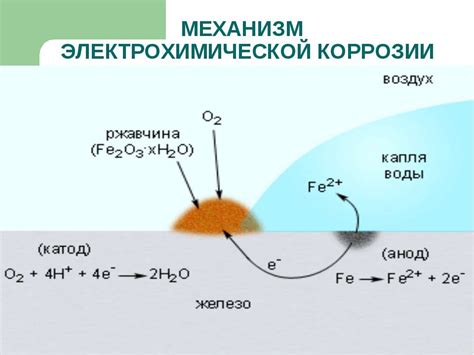
Электрохимическая коррозия металла - это процесс разрушения металлов под воздействием окружающей среды, при котором металлы реагируют с окружающей средой и подвергаются электрохимической реакции.
Электрохимическая коррозия металла происходит по принципу анодно-катодной реакции. На поверхности металла возникают аноды и катоды, которые связаны электрохимической цепью. На анодах происходит окисление металла, а на катодах – редукция окислителя. В результате такой реакции на поверхности металла образуются электролитические растворы, которые вызывают разрушение материала.
Процесс электрохимической коррозии металла зависит от множества факторов, таких как тип металла, состав окружающей среды, ее температура и влажность. Например, металлы, содержащие в составе железо или сталь, подвержены особенно интенсивной коррозии при взаимодействии с кислородом и влагой.
Для защиты металла от электрохимической коррозии применяются различные методы. Одним из методов является использование покрытий или защитных слоев на поверхности металла. Они могут быть выполнены из специальных материалов, которые не подвержены коррозии или препятствуют проникновению агрессивных веществ.
Важно отметить, что электрохимическая коррозия металла является достаточно сложной и длительной процессом, который может привести к серьезным повреждениям и потере функциональности металлических изделий. Поэтому важно предпринимать соответствующие меры по защите металла и осуществлять регулярный контроль его состояния.
Примеры электрохимической коррозии
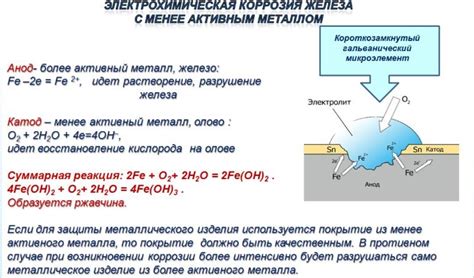
Электрохимическая коррозия является распространенным процессом разрушения металлических конструкций и предметов в окружающей среде. Вот некоторые примеры:
Коррозия железа: Одним из самых известных примеров электрохимической коррозии является ржавчина железа. При взаимодействии железа с водой и оксигеном происходит формирование химических реакций, которые вызывают разрушение металла.
Коррозия алюминия: Алюминий также подвержен электрохимической коррозии. Воздействие влаги и кислорода приводит к формированию оксидной пленки на поверхности алюминия, которая может быть разрушена воздействием других химических веществ.
Коррозия цинка: Цинк является одним из самых эффективных анодов для защиты других металлов. Однако, сам цинк подвержен электрохимической коррозии. Коррозия цинка может привести к образованию белого осадка на его поверхности.
Эти примеры демонстрируют, что электрохимическая коррозия может происходить с различными металлическими материалами и иметь разные результаты. Понимание принципов этого процесса позволяет разрабатывать методы предотвращения коррозии и защиты металлических конструкций.
Вопрос-ответ

Что такое электрохимическая коррозия?
Электрохимическая коррозия - это процесс разрушения металла под воздействием химических реакций, происходящих при непосредственном контакте металла с окружающей средой.
Какие факторы влияют на электрохимическую коррозию металла?
Факторы, влияющие на электрохимическую коррозию металла, включают в себя наличие влаги, наличие кислот и щелочей в окружающей среде, наличие электролитов, различные концентрации растворов и температуру.
Какие металлы наиболее подвержены электрохимической коррозии?
Некоторые металлы, такие как железо, алюминий и цинк, особенно подвержены электрохимической коррозии из-за своей химической реакции с окружающей средой. В то время как другие металлы, такие как золото и платина, имеют высокую стойкость к коррозии.
Как происходит электрохимическая коррозия?
В основе электрохимической коррозии лежит процесс окисления и восстановления, при котором происходят реакции между металлом и реагентами окружающей среды, что приводит к образованию коррозионных продуктов.
Как можно предотвратить электрохимическую коррозию металла?
Для предотвращения электрохимической коррозии металла можно использовать различные методы, такие как нанесение защитных покрытий на металлическую поверхность, использование антикоррозионных покрытий, контроль уровня влажности и поддержание оптимальных условий работы.
