Электрохимический потенциал металлов - это важное понятие в химии и электрохимии, которое определяет их способность к единству ионами в растворе. Каждый металл имеет свой собственный электрохимический потенциал, который может быть положительным или отрицательным.
Электрохимический потенциал металлов является ключевой характеристикой их активности в реакциях окисления и восстановления. Он определяет, насколько легко металл может отдать или принять электроны, что влияет на его способность реагировать с другими веществами.
Знание электрохимического потенциала металлов имеет большое значение в различных областях, таких как электрохимия, гальваника, коррозия и физико-химические процессы. Это позволяет ученым и инженерам определить, какие металлы можно использовать в различных условиях и реакциях, а также предсказать и предотвратить возможность коррозии металлов.
Как правило, металлы с более высоким электрохимическим потенциалом будут активнее, тогда как металлы с более низким электрохимическим потенциалом будут менее активными и более склонными к коррозии.
Важно понимать, что электрохимический потенциал металлов может изменяться в зависимости от реакций и условий окружающей среды. Он может быть измерен с помощью специальных методов и сравниваться с потенциалом стандартного электрода водорода. Это позволяет установить относительные значения электрохимического потенциала металлов и их реактивность в различных системах.
В итоге, электрохимический потенциал металлов является важным инструментом для изучения и понимания их химических и физических свойств, а также для определения их активности и возможности использования в различных областях науки и техники.
Что такое электрохимический потенциал металлов?
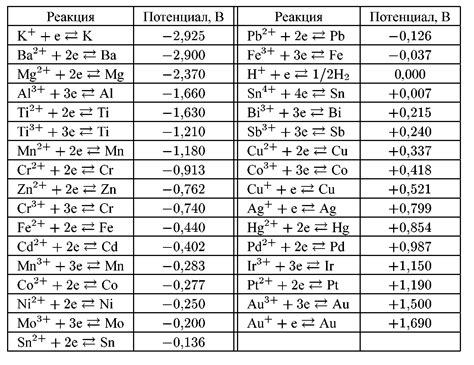
Электрохимический потенциал металлов – это величина, характеризующая способность металла вступать в реакцию с окружающей его средой. Он определяет, сколько энергии необходимо для переноса электрона через границу раздела между металлом и электролитом. Когда металл вступает в реакцию с окружающей средой, происходит процесс окисления или восстановления.
Электрохимический потенциал металлов измеряется в вольтах и может быть как положительным, так и отрицательным значением. Металлы с положительным потенциалом охотно отдают электроны и являются хорошими восстанавливающими агентами. Металлы с отрицательным потенциалом, наоборот, более склонны принимать электроны и выступают в роли окислительных агентов.
Электрохимический потенциал металлов является важным параметром, используемым в электрохимии и в процессе определения технологических сплавов. Он позволяет предсказывать, какие реакции могут происходить между металлами и другими веществами, а также позволяет выбрать оптимальные сочетания металлов для различных приложений.
Таблицы электрохимического потенциала металлов позволяют сравнивать способности металлов вступать в реакции с окружающей средой. На основе этих таблиц можно определить, какой металл будет приоритетно окисляться или восстанавливаться в реакциях, основанных на электрохимическом потенциале. Электрохимический потенциал металлов также используется для предсказания реакционной активности металлов и коррозионной стойкости материалов.
Определение и принцип работы
Электрохимический потенциал металлов является основной характеристикой их реакционной способности. Он определяет возможность металла участвовать в электрохимических процессах, таких как окисление и восстановление.
Основой для определения электрохимического потенциала является сравнение металла с испытательным электродом. Испытательный электрод имеет известный потенциал, и сравнение его с потенциалом металла позволяет определить, какой из них более активен и какие электрохимические реакции будут протекать.
Принцип работы основан на разности потенциалов между двумя полуэлементами. Если потенциал металла выше испытательного электрода, то металл имеет больший электрохимический потенциал и будет выступать в качестве анода, т.е. подвергаться процессу окисления.
На основе электрохимического потенциала металлов разработана шкала, изображающая их порядок относительной активности. Эта шкала, также известная как ряд напряжений, позволяет предсказать, какие реакции будут протекать в электрохимической системе и какие металлы будут выступать в качестве анодов или катодов.
Значение электрохимического потенциала
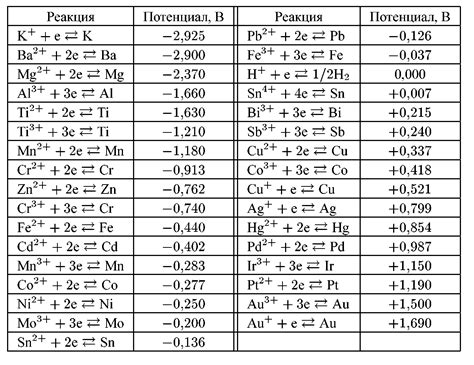
Электрохимический потенциал металла является важной характеристикой, определяющей его способность вступать в реакции окисления и восстановления. Он показывает, насколько легко электроны могут переходить соединения металла с его различными окислителями или восстановителями.
Значение электрохимического потенциала определяется стандартным электродным потенциалом металла. Для каждого металла этот показатель может быть разным и указывается в отношении стандартного водородного электрода. Водаородный электрод, считающийся нейтральным, имеет электрохимический потенциал равный 0 Вольт.
Значения электрохимического потенциала металлов позволяют определить их реакционную активность. Металлы с более высоким электрохимическим потенциалом являются более активными и склонными к окислительным реакциям. Металлы с более низким электрохимическим потенциалом, наоборот, более стабильны и склонны к восстановительным реакциям.
Исходя из значений электрохимического потенциала металлов, можно определить их порядок в ряду активностей металлов. Чем выше у металла электрохимический потенциал, тем выше его активность. В ряду активностей металлов находятся элементы, начиная с наиболее активных металлов, таких как калий или натрий, и заканчивая наименее активным металлом, таким как золото или платина.
Измерение электрохимического потенциала

Измерение электрохимического потенциала металлов является важным методом для определения их активности в различных электрохимических процессах. Электрохимический потенциал выражает способность металла отдавать или принимать электроны в химическом взаимодействии с окружающей средой.
Определение электрохимического потенциала производится с помощью электрохимических ячеек, включающих исследуемый металл и эталонный электрод. Эталонный электрод имеет известное значение потенциала и служит для сравнения с потенциалом исследуемого металла. Наиболее распространенными эталонными электродами являются стандартный водородный электрод (SHE) и стандартный калий-хлорсеребрацетатный электрод (Ag/AgCl).
Измерение производится путем подключения исследуемого металла и эталонного электрода к вольтметру с помощью проводов, а затем погружением в раствор электролита. Раствор электролита обеспечивает химическую связь между металлом и эталонным электродом. Вольтметр измеряет разность потенциалов между исследуемым металлом и эталонным электродом, что позволяет определить электрохимический потенциал металла.
Значение электрохимического потенциала металла может использоваться для предсказания его реактивности в различных химических системах. Высокий электрохимический потенциал обычно указывает на большую активность металла и его склонность к окислению. Низкий электрохимический потенциал, наоборот, указывает на меньшую активность металла и его склонность к восстановлению.
Измерение электрохимического потенциала металлов имеет широкое применение в различных областях, включая электрохимию, гальваническую коррозию, электролиз и процессы с электрохимическими реагентами. Этот метод позволяет не только определить потенциал и активность металлов, но и изучать их химические свойства и связи с другими веществами.
Вопрос-ответ

Какой физический смысл имеет электрохимический потенциал металлов?
Электрохимический потенциал металлов — это физическая величина, которая определяет их способность вступать в электрохимические реакции. Он характеризует тенденцию металла отдавать или принимать электроны при взаимодействии с другими веществами.
Каким образом измеряется электрохимический потенциал металлов?
Электрохимический потенциал металлов измеряется относительно стандартного водородного электрода. Значения потенциалов металлов приводятся в таблицах, представляющих собой последовательность металлов по убыванию их потенциалов. Обычно электрохимический потенциал металлов измеряется в вольтах.
Почему некоторые металлы имеют положительный электрохимический потенциал, а другие – отрицательный?
Положительный электрохимический потенциал металлов означает, что они способны отдавать электроны и вступать в окислительные реакции. А отрицательный потенциал указывает на то, что металлы способны принимать электроны и вступать в восстановительные реакции. Различие в потенциалах металлов связано с их электрохимической активностью и тенденцией к взаимодействию с другими веществами.
Как электрохимический потенциал металлов влияет на коррозию?
Электрохимический потенциал металлов определяет их склонность к коррозии. Если два металла с разными потенциалами находятся в контакте в присутствии электролита, то возникает гальваническая пара, что приводит к коррозии одного из металлов. Металл с более низким электрохимическим потенциалом становится анодом и начинает активно окисляться, а металл с более высоким потенциалом становится катодом и не подвержен коррозии.
