В металлургии и электрохимии важную роль играет электрохимический потенциал металлов. Этот параметр определяет способность металла переносить электроны при электрохимических реакциях. Одним из важнейших аспектов электрохимического потенциала является различие между анодами и катодами.
Анод – это электрод, на котором происходит окисление, то есть выделение электронов. При этом анод становится источником положительных ионов. Анод имеет положительный электрохимический потенциал, так как в электролите он является областью повышенной концентрации положительных ионов.
В отличие от анода, катод – это электрод, на котором происходит восстановление, то есть поглощение электронов. Катод является зоной повышенной концентрации отрицательных ионов, поэтому он имеет отрицательный электрохимический потенциал. На поверхности катода происходит окислительно-восстановительная реакция, при которой электроны перемещаются с анода на катод.
Электрохимический потенциал металлов играет важную роль не только в электролизе и гальванических элементах, но и во многих других процессах, таких как коррозия и покрытия. Понимание особенностей анодов и катодов позволяет оптимизировать процессы и выбрать подходящие материалы для конкретных задач.
Электрохимический потенциал металлов: значение и особенности
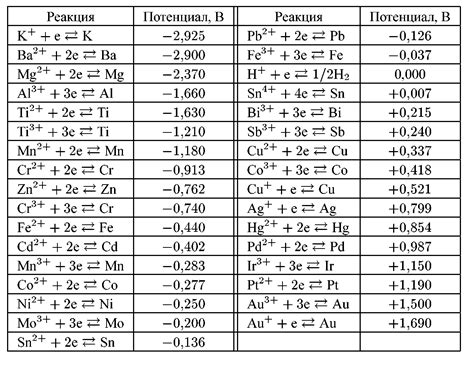
Электрохимический потенциал металлов является важным параметром при рассмотрении их использования в различных электрохимических процессах. Этот параметр показывает способность металла отдавать электроны, что в свою очередь определяет его реакционную активность.
Каждый металл имеет свой уникальный электрохимический потенциал, который выражается величиной электродного потенциала (вольт). Электрохимический потенциал металла можно рассматривать в контексте двух полуэлементов - анода и катода.
Анод - это половина реакции окисления, когда металл отдает электроны. Катод - это половина реакции восстановления, когда вещество принимает электроны. При этом, металл с более высоким электрохимическим потенциалом будет выступать в качестве анода, а металл с более низким потенциалом - в качестве катода.
Важной особенностью электрохимического потенциала металлов является их способность к коррозии. Металлы с более высоким потенциалом склонны к коррозии, так как они легче отдают электроны и окисляются. Металлы с более низким потенциалом, наоборот, меньше подвержены коррозии, так как они принимают электроны и восстанавливаются.
Изучение электрохимического потенциала металлов позволяет определить их устойчивость к коррозии, провести сравнительный анализ различных металлических материалов и принять эффективные меры по защите от коррозии.
Аноды: металлические электроды в электрохимических процессах
Аноды играют важную роль в электрохимических процессах, так как они являются металлическими электродами, на которых происходит окисление вещества. Аноды имеют положительный заряд и являются источниками электронов для катодов. Они выделяют положительные ионы и участвуют в реакциях окисления восстановления.
Аноды обладают высокими электрохимическими потенциалами, что обеспечивает эффективное протекание электрохимических процессов. Они могут быть изготовлены из различных материалов, таких как железо, алюминий, цинк, медь и другие металлы. Выбор материала анода влияет на электрохимические свойства процессов и может определять его долговечность и стабильность.
Аноды также используются в различных промышленных процессах, таких как электролиз, гальванизация и коррозия. Они могут быть использованы для обработки поверхностей металлов, создания защитных покрытий и производства различных химических веществ. Кроме того, аноды могут быть использованы в батареях и аккумуляторах для хранения и высвобождения электрической энергии.
В заключение, аноды являются важными компонентами электрохимических процессов, обеспечивая прохождение окислительно-восстановительных реакций и использование электрической энергии. Они обладают высокими электрохимическими потенциалами и могут быть изготовлены из различных материалов. Аноды играют важную роль в промышленности, науке и технологии, обеспечивая различные процессы и применения.
Катоды: ключевые элементы электролиза и гальванических ячеек
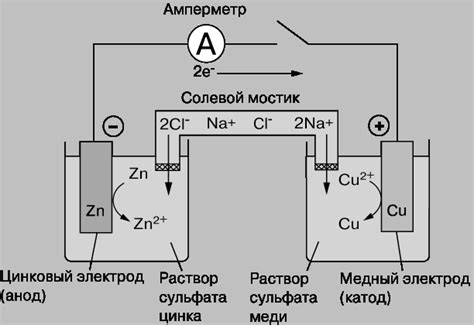
В электрохимическом процессе катод является одним из ключевых элементов. Катод – это электрод, на который направляются электроны или ионы для прохождения редокс-реакции. Катодный процесс часто связан с процессом восстановления вещества.
В электролизе катод играет важную роль, так как на него направляются электроны или ионы, именно на катоде происходит процесс восстановления. Катод может быть сделан из различных материалов, таких как медь, никель, платина и т.д. При электролизе на катоде происходит процесс отделения металла от электролита.
Катоды также являются важным элементом в гальванических ячейках. Гальваническая ячейка – это электрохимическая система, которая преобразует химическую энергию в электрическую. В гальванической ячейке катод служит для принятия электронов, которые освобождаются при окислительно-восстановительной реакции с анодом.
Катоды в гальванических ячейках могут быть изготовлены из различных материалов. Например, в свинцово-кислородной гальванической ячейке катодом служит свинцовый электрод, на котором происходит процесс восстановления свинца. Также в гальванических ячейках катод может быть выполнен из меди, цинка или других металлов.
Катоды являются важными элементами электролиза и гальванических ячеек, так как они отвечают за процесс восстановления вещества и принятие электронов или ионов. Выбор материала для катода зависит от конкретной электрохимической системы и желаемых результатов.
Вопрос-ответ

Что такое электрохимический потенциал металлов?
Электрохимический потенциал металлов - это электрический потенциал, создаваемый металлами в растворе электролита. Он измеряется в вольтах и характеризует способность металла отдавать или принимать электроны в химической реакции.
Что такое аноды и катоды в электрохимических реакциях?
Анод - это электрод, на котором происходит окисление, то есть отдача электронов. Катод, напротив, является электродом, на котором происходит восстановление, то есть прием электронов.
Какие особенности свойственны анодам в электрохимических реакциях?
Аноды в электрохимических реакциях имеют положительный заряд и отдают электроны. Они характеризуются высоким электрохимическим потенциалом и склонностью к окислению.
Каковы особенности катодов в электрохимических реакциях?
Катоды в электрохимических реакциях имеют отрицательный заряд и принимают электроны. Они обладают низким электрохимическим потенциалом и склонностью к восстановлению.
