Электрохимический потенциал металла является одной из основных характеристик, определяющих его реакционную способность и поведение в химических реакциях. Этот параметр позволяет оценить способность металла к окислению или восстановлению в электрохимических процессах.
Принцип работы электрохимического потенциала металла основан на разности энергии, возникающей при переносе электрона от металла к раствору или наоборот. Это связано с тем, что атомы металла в растворе могут находиться в различных степенях окисления - положительных или отрицательных. Если металл ионизируется, то его потенциал будет положительным, а при обратном процессе – отрицательным. Это объясняет способность металлов к реакциям окисления и восстановления.
Электрохимический потенциал металла оказывает влияние на процессы окисления и восстановления. Каждый металл имеет свой уникальный потенциал, что определяется его структурой и химическими свойствами. Металл с более высоким электрохимическим потенциалом будет склонен отдавать электроны и окисляться, тогда как металл с более низким потенциалом будет склонен принимать электроны и восстанавливаться. Это принципиальное свойство металлов позволяет использовать их в электрохимических и гальванических системах, в батареях и аккумуляторах.
Понимание электрохимического потенциала металла важно для множества прикладных наук, включая электрохимию, металлургию и материаловедение. Знание этого параметра позволяет правильно выбирать материалы для конструкций, обеспечивать их защиту от коррозии, а также применять металлы в различных технологических процессах. Электрохимический потенциал металла играет ключевую роль в понимании и управлении его химическими свойствами и поведением в реакциях окисления и восстановления.
Электрохимический потенциал металла
Электрохимический потенциал металла - это мера его способности вступать в окислительно-восстановительные реакции. Каждый металл имеет свой характерный электрохимический потенциал, который определяется его атомной структурой и взаимодействием с окружающей средой.
Электрохимический потенциал металла является ключевым параметром при проведении электрохимических процессов, таких как коррозия, гальваническая защита и электролиз. Он определяет направление потока электронов между металлом и электролитом, а также скорость окисления или восстановления металла.
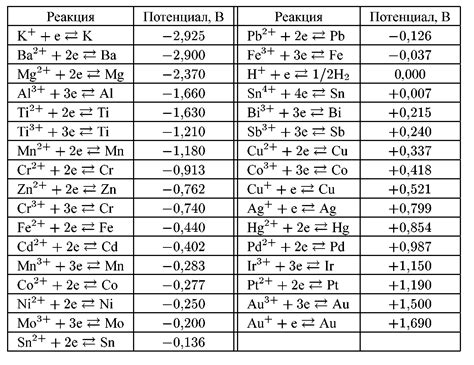
Электрохимический потенциал металла может быть измерен с использованием базового образца, такого как стандартный водородный электрод. Разница потенциалов между металлом и стандартным водородным электродом называется электродным потенциалом металла и позволяет сравнивать относительную активность металлов.
Металлы с более высоким электрохимическим потенциалом обладают большей склонностью к окислению, тогда как металлы с более низким потенциалом легче подвергаются восстановлению. Это явление известно как электрохимический ряд металлов и служит основой для проведения различных электрохимических процессов.
Понимание электрохимического потенциала металла позволяет контролировать и управлять процессами окисления и восстановления. Например, при проведении гальванической защиты металла от коррозии, используется принцип раздельного положения металлов в электрохимическом ряду, чтобы обеспечить защиту более активного металла за счет его окисления вместо более пассивного металла.
Принцип работы
Электрохимический потенциал металла является мерой его способности окисляться или восстанавливаться в химических реакциях. Он определяется разницей в электрохимическом потенциале между металлом и его окружающей средой.
При наличии такой разницы потенциалов возникает электрическое поле, которое приводит к течению электронов от металла к окружающей среде или наоборот. Этот процесс называется окислительно-восстановительной реакцией.
Электрохимический потенциал у каждого металла свой. Принцип работы заключается в том, что металлы с более высоким электрохимическим потенциалом имеют большую способность к окислению, тогда как металлы с более низким потенциалом склонны к восстановлению.
Электрохимический потенциал металла может быть измерен относительно стандартного электрода, такого как стандартный водородный электрод. По значению этого потенциала можно определить, является ли металл анодом или катодом в электрохимических реакциях.
Знание электрохимического потенциала металла позволяет предсказать его поведение в определенных условиях, а также оптимизировать процессы окисления и восстановления для достижения желаемого результата.
Влияние на процессы окисления и восстановления

Электрохимический потенциал металла играет важную роль в процессах окисления и восстановления. Он определяет способность металла к участию в этих процессах и влияет на скорость и направление реакций.
Если металл имеет более высокий электрохимический потенциал, чем другой металл в контакте с ним, то процесс окисления происходит на первом металле, а восстановление - на втором. Это означает, что первый металл теряет электроны и окисляется, а второй металл получает эти электроны и восстанавливается.
При этом процессы окисления и восстановления металла могут протекать быстрее или медленнее в зависимости от его электрохимического потенциала. Металлы с более высоким потенциалом обладают большей склонностью к окислению, в то время как металлы с более низким потенциалом более легко восстанавливаются.
Электрохимический потенциал металла также может влиять на протекание коррозионных процессов. Металлы с более высоким потенциалом обычно подвержены большей степени коррозии, так как они имеют большую тенденцию к окислению. В то же время, металлы с более низким потенциалом могут служить анодами и жертвенными анодами, защищая другие металлические элементы от коррозии.
Кроме того, электрохимический потенциал металла может изменяться под влиянием различных факторов, таких как температура, pH среды и наличие агрессивных веществ. Изменение потенциала может влиять на скорость процессов окисления и восстановления, а также на степень коррозии металла. Поэтому важно учитывать электрохимический потенциал металла при проектировании и эксплуатации различных систем и конструкций.
Значение в химических реакциях

Электрохимический потенциал металла играет важную роль в химических реакциях, особенно в процессах окисления и восстановления. Он определяет, насколько легко металл может отдать или принять электроны и вступить в реакцию с другими веществами.
Если металл имеет высокий электрохимический потенциал, он будет сильным окислителем и способен легко отдавать электроны, образуя положительно заряженные ионы. Это значит, что металл будет активно окисляться в реакциях с другими веществами.
С другой стороны, если металл имеет низкий электрохимический потенциал, он будет слабым окислителем и не сможет легко отдавать электроны. Вместо этого он будет склонен принимать электроны и вступать в реакцию как восстановитель. Такой металл будет активно реагировать с оксидами и другими веществами, принимая электроны от них.
Знание электрохимического потенциала металлов позволяет определить их способность к реакциям окисления и восстановления. Это имеет практическое применение в различных областях, таких как электрохимия, коррозия металлов, электролиз и многих других процессах, где важно управлять реакциями переноса электронов.
Практическое применение

Электрохимический потенциал металла находит широкое практическое применение во многих областях, включая электрохимию, гальванику, биоэлектронику и электроизоляцию. В электрохимии он используется для определения направления и скорости окислительно-восстановительных реакций.
Гальваника — это область, связанная с производством и использованием гальванических элементов и аккумуляторов. Знание электрохимического потенциала металлов позволяет выбирать материалы для создания гальванических элементов с желаемыми свойствами. Это особенно важно при проектировании батарей и аккумуляторов, где необходимо обеспечить оптимальное сочетание энергетической емкости и длительного срока службы.
В биоэлектронике электрохимический потенциал металла используется для создания электродов, которые могут быть внедрены в организм человека для мониторинга и стимуляции электрической активности в нервной и мышечной системах. Некоторые металлы, такие как платина и золото, обладают высокой биокомпатибельностью и низкой коррозионной стойкостью, что делает их идеальными материалами для создания биоэлектродов.
В области электроизоляции электрохимический потенциал металла играет роль определяющего фактора в выборе материалов для создания изоляционных покрытий. Материалы с низким электрохимическим потенциалом металла обеспечивают лучшую защиту от коррозии и электролиза, что делает их незаменимыми для защиты металлических конструкций от воздействия агрессивных сред и увеличения их срока службы.
Вопрос-ответ

Что такое электрохимический потенциал металла?
Электрохимический потенциал металла - это мера его способности окисляться или восстанавливаться в реакции, происходящей в электрохимической системе. Он определяет электронный потенциал металла и зависит от его химических свойств и физической структуры.
Какова роль электрохимического потенциала металла в процессах окисления и восстановления?
Электрохимический потенциал металла играет важную роль в процессах окисления и восстановления. Когда два различных металла находятся в контакте в присутствии электролита, то происходит разделение на анод и катод. Металл с более высоким электрохимическим потенциалом становится анодом и окисляется, а металл с более низким потенциалом становится катодом и восстанавливается. Таким образом, электрохимический потенциал металла определяет направление процессов окисления и восстановления в электрохимической системе.
