Металлы являются одним из наиболее важных классов материалов в нашем мире. Их электрохимические свойства играют значительную роль в множестве процессов, начиная от промышленных производств и заканчивая бытовым использованием. Понимание основных характеристик электрохимического поведения металлов является необходимым для разработки новых материалов и улучшения существующих технологий.
Основной характеристикой электрохимического поведения металлов является их способность взаимодействовать с окружающей средой через электрохимические процессы. Это включает в себя оказание влияния на окружающую среду и саму металлическую структуру через электролитические реакции и коррозию.
Одним из наиболее известных примеров электрохимического поведения металлов является коррозия. Коррозия – это процесс разрушения металла под воздействием окружающей среды, такой как вода и воздух. Она может привести к потере прочности и долговечности металлических конструкций и изделий. Понимание электрохимических основ коррозии позволяет разрабатывать методы защиты от коррозии и выбирать подходящие материалы для конкретных условий эксплуатации.
Что такое электрохимические свойства металла
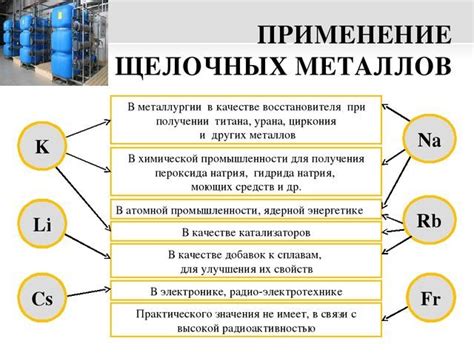
Электрохимические свойства металла относятся к его способности взаимодействовать с окружающей средой при прохождении электрического тока. Эти свойства играют важную роль в различных процессах и приложениях, таких как электролиз, гальваническая коррозия, аккумуляторы и другие электрохимические устройства. Данные свойства определяются химической реакцией, происходящей на поверхности металла во время проведения электрического тока.
Основной параметр, который характеризует электрохимические свойства металла, - это его потенциал окисления (или потенциал электрода). Потенциал окисления определяет, насколько легко металл может отдать электроны во время электрохимической реакции.
У металлов могут быть различные потенциалы окисления, что определяет их относительную активность. Некоторые металлы, такие как литий и калий, имеют низкий потенциал окисления и легко отдают электроны, демонстрируя высокую активность. Другие металлы, такие как золото и платина, имеют высокий потенциал окисления и обладают низкой активностью.
Электрохимические свойства металлов используются во множестве практических приложений. Например, в гальванической коррозии, более активный метал служит анодом, отдавая электроны, а менее активный метал становится катодом, принимая электроны. В аккумуляторах, электрическая энергия может быть хранена благодаря электрохимической реакции, происходящей на поверхности металла. Такие процессы электролиза и электроосаждения, основанные на электрохимическом взаимодействии металла с раствором, широко применяются в химической промышленности и лабораториях.
Определение и основные характеристики

Электрохимические свойства металла - это его способность взаимодействовать с другими веществами и образовывать электрические потенциалы. Каждый металл имеет свои характеристики и особенности, определяющие его поведение в электрохимических реакциях.
Одной из основных характеристик металла является его электронная проводимость. Металлы обладают высокой электронной проводимостью благодаря наличию свободных электронов в металлической структуре. Это позволяет им легко передвигаться внутри металла и участвовать в электрических реакциях.
Еще одной важной характеристикой металла является его электрохимический потенциал. Электрохимический потенциал определяет способность металла отдавать или принимать электроны в реакциях окисления и восстановления. Металлы с более высоким потенциалом легче отдают электроны, а металлы с более низким потенциалом легче принимают электроны.
Комбинация электронной проводимости и электрохимического потенциала делает металлы важными компонентами в различных электрохимических системах. Например, они широко применяются в батареях и аккумуляторах, где металлы выполняют роль анодов или катодов и участвуют в электрохимических реакциях, генерирующих электрическую энергию.
В общем, электрохимические свойства металла играют важную роль в различных промышленных и научных областях, от энергетики до химического производства, и позволяют использовать металлы в разнообразных электрохимических процессах.
Реакция металла с окружающей средой

Металлы обладают способностью взаимодействовать с окружающей средой, что приводит к изменению их свойств и структуры. Этот процесс называется коррозией. Коррозия может происходить под воздействием влаги, кислорода, кислот, солей, и других химических веществ, находящихся в окружающей среде.
Реакция металла с окружающей средой приводит к образованию коррозионных продуктов. Эти продукты могут быть в виде оксидов, гидроксидов, солей металлов и других соединений. Например, железо при контакте с водой и кислородом окисляется и образует ржавчину – гидроксид железа (III) и оксид железа (III).
Коррозия оказывает негативное влияние на металлы, приводя к их разрушению и потере ценных свойств. Чтобы предотвратить коррозию, металлы покрывают защитными слоями, например, гальваническим покрытием, оксидным покрытием или применяют специальные защитные покрытия.
Реакция металла с окружающей средой также может использоваться в практических целях. Например, гальваническая коррозия или электролиз могут быть использованы для защиты металлов или для получения токопроводящих материалов. Также металлы используются в электрохимических элементах, таких как батарейки или аккумуляторы, где происходят реакции между металлом и электролитом.
Влияние на электрохимические свойства

На электрохимические свойства металла влияют различные факторы, в том числе его состав, структура и поверхностные особенности. Одним из основных параметров, определяющих электрохимическую активность металла, является его электрохимический потенциал, который может быть положительным, отрицательным или равным нулю.
Состав металла оказывает существенное влияние на его электрохимические свойства. Например, присутствие различных примесей может изменить электрохимический потенциал металла и его склонность к окислению или восстановлению. Кроме того, состав металла может влиять на его коррозионную стойкость и способность к формированию защитных покрытий.
Структура металла также играет важную роль в его электрохимических свойствах. Например, кристаллическая решетка металла может представлять собой электрохимически активные или пассивные поверхности, в зависимости от ее ориентации и регулярности. Кроме того, структура металла может влиять на его проводимость электролита и возможность реакций передвижения ионов.
Поверхностные особенности металла также могут оказывать существенное влияние на его электрохимические свойства. Например, наличие оксидных пленок, пассивирующих покрытий или микронеровностей поверхности может снижать электрохимическую активность металла или способствовать его коррозии. Кроме того, поверхность металла может служить местом адсорбции и реакций с электролитом, что также влияет на его электрохимические свойства.
Применение электрохимических свойств металла
Электрохимические свойства металлов нашли широкое применение в различных областях науки и техники.
Одним из наиболее известных применений электрохимических свойств металла является их использование в элементах и батареях. Металлы, такие как литий, цинк и магний, обладают способностью активно вступать в химические реакции с кислородом или другими веществами, что позволяет использовать их в качестве анодов или катодов в элементах. Благодаря этому, металлы могут служить источником электроэнергии и использоваться в батареях для питания устройств.
Другим важным применением электрохимических свойств металла является их использование в процессе электролиза. При электролизе металлы могут быть разложены на ионы, которые затем могут быть использованы в различных химических и технических процессах. Например, алюминий производится из алюминиевого оксида путем электролиза расплавленной массы. Этот метод позволяет получить высокоочищенный металл с высокой степенью чистоты и используется в металлургической промышленности.
Далее, электрохимические свойства металлов также находят применение в гальванической покраске. Металлы, такие как цинк, железо или хром, могут быть осаждены на поверхности других металлов с помощью электрического тока. Этот процесс позволяет изменять цвет и свойства поверхности металла, защищать его от коррозии или придавать ему декоративный вид. Гальваническая покраска широко применяется в промышленности, автомобильном производстве и других отраслях.
В производстве и технологиях
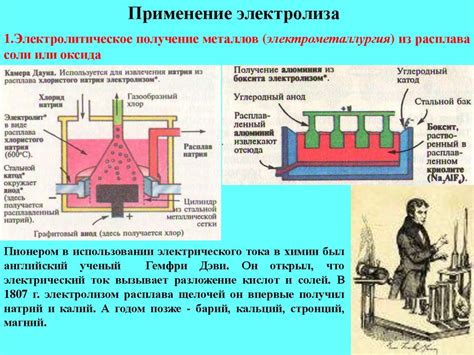
Электрохимические свойства металлов находят широкое применение в различных производственных и технологических процессах. В основе этих свойств лежит способность металлов к электрохимическим реакциям, в которых они выступают в качестве электродов.
Одним из наиболее распространенных применений электрохимических свойств металлов является их использование в процессах гальванизации. Гальванизация – это метод нанесения защитных или декоративных покрытий на различные поверхности. В этом процессе металлы выступают в качестве одного из электродов, а покрываемая поверхность – в качестве другого. Путем подачи электрического тока на электроды происходит электрохимическая реакция, в результате которой на поверхность обрабатываемого предмета осаживается металлическое покрытие.
Электрохимические свойства металлов также используются в процессах электролиза. Электролиз – это метод разделения веществ на составные элементы при помощи электрического тока. В процессе электролиза металлы выступают в качестве электродов, между которыми располагается электролит – раствор вещества, подвергаемого электролизу. Под действием электрического тока происходит разложение вещества на ионы, которые притягиваются к соответствующим электродам. Это позволяет получить чистые металлы или производные вещества.
Другим применением электрохимических свойств металлов являются аккумуляторы. Аккумулятор – это устройство, способное накапливать электрическую энергию. Основой аккумулятора являются электрохимические реакции, происходящие между двумя электродами – анодом и катодом. В процессе зарядки аккумулятора происходят электрохимические реакции, в результате которых электрическая энергия превращается в химическую энергию. При разрядке аккумулятора происходят обратные электрохимические реакции, и химическая энергия превращается в электрическую энергию.
Вопрос-ответ

Какие основные свойства металла определяют его электрохимические характеристики?
Основные свойства металла, определяющие его электрохимические характеристики, включают электронную проводимость, степень ионизации и электроотрицательность. Электронная проводимость позволяет металлу быть электродом, а степень ионизации и электроотрицательность влияют на его способность вступать в химические реакции, такие как окисление и восстановление.
Какие применения имеют электрохимические свойства металлов?
Электрохимические свойства металлов имеют широкий спектр применений. Например, электрохимическая коррозия металла может быть снижена или предотвращена с помощью покрытий, таких как гальваническое покрытие. Также металлы могут использоваться в электролизе для производства различных веществ, таких как алюминий и хлор, или для выделения металлов из руд. Электрохимические свойства металлов также используются в батареях и аккумуляторах для хранения и освобождения электрической энергии.
