Электрохимическая коррозия – один из наиболее распространенных и долговечных процессов разрушения металлов. Она является результатом химических реакций, происходящих между металлом и окружающей средой в присутствии электролита. Но насколько интенсивной будет происходить коррозия зависит от многих факторов, в том числе от напряжений, которые действуют на металлы.
Напряжения могут возникать в металлах как результат их взаимодействия с окружающей средой. В результате такого взаимодействия может происходить дисбаланс в зарядах между различными частями металла, что приводит к возникновению локальных разности потенциалов, или напряжений. Затем эти напряжения вызывают появление электрических токов внутри металла, что активирует электрохимические реакции и способствует процессу коррозии.
Влияние напряжений на электрохимическую коррозию металлов может быть разнообразным. Возможны ситуации, когда напряжение приводит к ускорению процесса коррозии, либо, наоборот, замедлению или полной блокировке. Все это зависит от комбинации различных факторов, таких как тип металла, окружающая среда, температура, концентрация электролита и других условий.
Влияние напряжений на электрохимическую коррозию металлов

Электрохимическая коррозия является одной из основных причин разрушения металлов. Она возникает при взаимодействии металла с окружающей средой под воздействием электрического тока. Важным фактором, влияющим на этот процесс, является наличие напряжений в системе.
Напряжения могут возникать как в результате внешних электрических источников, так и внутри металла в результате химических реакций. Они могут ускорять или замедлять процесс коррозии с разной интенсивностью в зависимости от характеристик металла и окружающей среды.
Напряжение может способствовать ускоренной коррозии, если оно создает условия для образования электролитической ячейки. В этом случае некоторые участки металла становятся анодами и начинают активно окисляться, тогда как другие участки становятся катодами и происходит их редукция. Это приводит к образованию коррозионных продуктов и разрушению металла.
С другой стороны, напряжение может также оказывать защитное влияние, если оно препятствует процессам окисления и редукции. Так, например, металлический слой, образующийся на поверхности металла под действием электрического тока, может служить барьером, предотвращающим проникновение агрессивных сред внутрь металла и, следовательно, замедляющим процесс коррозии.
Выводя электрохимическую коррозию металлов на новый уровень, необходимо учитывать влияние напряжений на этот процесс и находить оптимальные условия, при которых можно достичь наибольшей стабильности металлических конструкций.
Основные понятия электрохимической коррозии металлов

Электрохимическая коррозия – это процесс разрушения металлических материалов в результате химических реакций, вызванных взаимодействием с окружающей их средой. Коррозия может приводить к повреждению металлических конструкций, преждевременному износу и потере функциональных свойств.
Одним из ключевых понятий в электрохимической коррозии является электрод – зона металлической поверхности, где протекают электрохимические реакции. Электроды делятся на аноды и катоды, в зависимости от наличия окислительного и восстановительного процессов соответственно.
Действие коррозии основано на принципе гальванической серии. Это последовательность металлов с различной степенью активности, которые взаимодействуют при наличии электролита. В результате этого взаимодействия возникают протекающие электрохимические потенциалы, которые определяют интенсивность коррозии.
Поляризация – это изменение потенциала электродов под воздействием внешнего электрического или химического фактора. Поляризацию можно классифицировать как анодную и катодную, в зависимости от изменения потенциала в сторону увеличения активности анода или катода.
Одним из методов защиты от коррозии является катодная защита. Она основана на создании электрохимических условий, которые препятствуют выходу металлической поверхности в анодные зоны и тем самым уменьшают скорость коррозии. Для этого используются различные методы и приборы, такие как импульсная катодная защита, гальваническая защита и прочие.
Пассивация – это способ устойчивого запирания поверхности металла от окружающих вредных воздействий. Пассивация осуществляется путем образования защитно-пассивной пленки на поверхности металла. Например, пассивацию стали можно достичь путем образования оксида железа Fe2O3.
Виды электрохимической коррозии металлов
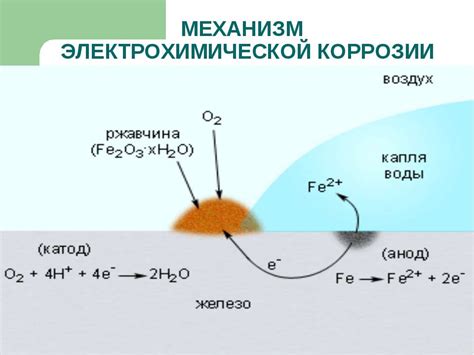
Электрохимическая коррозия металлов может происходить в различных условиях и иметь разные причины. В зависимости от напряжений, действующих на металл, можно выделить несколько видов электрохимической коррозии.
Первый вид – гальваническая коррозия. Она происходит при контакте разных металлов, из которых состоит объект. В результате этого контакта, между металлами проводится ток, что приводит к коррозии одного или нескольких металлов.
Другой вид – концентрационная коррозия. Она возникает при наличии разницы концентраций раствора или разности pH, образующихся в результате химических реакций между металлом и средой. Под действием этих различий, происходит процесс электрохимической коррозии.
Также существует аероэрозионная коррозия, которая возникает под воздействием воздушного потока, содержащего агрессивные газы и частицы. В результате деятельности аэроэрозии, на поверхности металла образуются активные центры, которые взаимодействуют с окружающей средой и приводят к коррозии.
И, наконец, коррозия под наливом. Она возникает при заполнении резервуара металлической жидкостью. В основу данного вида коррозии положена разница между растворенным газом в жидкости и газом в атмосфере. Под действием разницы давления и концентрации, металл подвергается коррозии.
Факторы, влияющие на электрохимическую коррозию
Электрохимическая коррозия металлов может быть вызвана рядом факторов, которые влияют на химические реакции между металлом и окружающей средой. Одним из основных факторов является наличие влаги, так как вода является хорошим проводником электричества и увеличивает скорость электрохимических процессов.
Кроме влаги, к коррозии металлов может привести наличие различных растворов, содержащих соли или кислоты. Эти вещества могут служить каталитическими агентами для реакции окисления металла и ускорять процесс коррозии.
Также важным фактором является наличие кислорода, так как при его взаимодействии с металлом образуется окись, которая может быть дальнейшим объектом коррозии. Кислород может присутствовать в атмосфере или в окружающей среде в свободном виде или быть связанным в воде или других химических соединениях.
Температура окружающей среды также оказывает влияние на процесс электрохимической коррозии металлов. Повышение температуры увеличивает скорость химических реакций и, следовательно, ускоряет коррозию.
Наконец, электрические потенциалы имеют значительное значение для электрохимической коррозии. Когда различные металлы находятся в контакте друг с другом, может возникать так называемая гальваническая пара, в результате чего происходит течение электрического тока, способствующего коррозии одного из металлов.
Механизмы электрохимической коррозии металлов
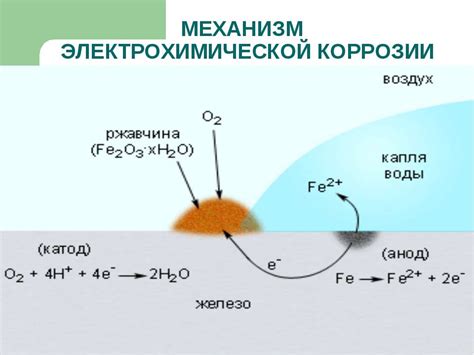
Электрохимическая коррозия металлов является процессом, при котором металлы подвергаются разрушению вследствие взаимодействия с окружающей средой. Данный процесс основан на электрохимической реакции, в которой металл выступает в качестве анода и окружающая среда в качестве катода.
Происходящие при этом электрохимические реакции приводят к образованию коррозионного электролита, который ускоряет дальнейшую коррозию металла. Один из механизмов коррозии – это пассивация металла, когда на его поверхности образуется защитная оксидная пленка, предотвращающая дальнейшую коррозию. Однако, при нарушении целостности пленки или воздействии агрессивных веществ, происходит разрушение пленки и возобновление процесса коррозии.
Еще одним механизмом электрохимической коррозии является создание гальванической пары между металлами, которая осуществляется при наличии различных потенциалов. Здесь один металл выступает в качестве анода, а другой в качестве катода. При наличии электролита, например, влаги или солей, происходит протекание электрохимических процессов и коррозия одного металла в ущерб другому.
- Механизмы электрохимической коррозии металлов:
- Пассивация металла;
- Гальваническая коррозия.
Уровни напряжений и их влияние на коррозию

Электрохимическая коррозия – это процесс разрушения металлов под воздействием химических реакций, которые происходят при прохождении электрического тока через металлы.
Важным фактором, влияющим на скорость разрушения металла в результате коррозии, является уровень напряжений, действующих на металлическую поверхность. Напряжения могут возникать вследствие контакта металла с различными средами или из-за применения внешних источников электрической энергии.
Высокие уровни напряжений могут привести к интенсивному разрушению металла и ускоренной коррозии. Например, при применении постоянного электрического тока на металлическую поверхность, химические реакции, связанные с коррозией, происходят более интенсивно. Высокое напряжение создает ускоренный поток электронов, что способствует активации химических реакций, отвечающих за разрушение металла.
С другой стороны, низкие уровни напряжений могут замедлить процессы коррозии. В ряде случаев напряжения подавляют химические реакции, связанные с разрушением металла, и уменьшают скорость протекания коррозионного процесса.
Правильный выбор и контроль уровней напряжений, воздействующих на металлические конструкции, особенно в условиях высокой влажности или агрессивных сред, может существенно снизить риск коррозии и продлить срок службы металлических изделий.
Методы предотвращения напряженной электрохимической коррозии
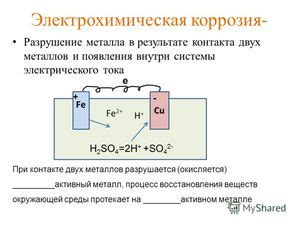
Напряженная электрохимическая коррозия является одной из наиболее разрушительных форм коррозии металлов. Она возникает при наличии разностей потенциалов между различными областями металла, что приводит к соединению анодных и катодных участков и, в конечном итоге, к разрушению материала. Для предотвращения такой коррозии существуют различные методы, которые могут быть использованы в зависимости от конкретной ситуации.
Один из основных методов предотвращения напряженной электрохимической коррозии – это использование защитных покрытий на поверхности металла. Такие покрытия создают барьер, который предотвращает контакт металла с окружающей средой и, следовательно, снижает вероятность возникновения различий потенциалов. Популярными защитными покрытиями являются эмали, краски, антикоррозионные покрытия и пленки, которые наносятся на поверхность металла.
Другим методом предотвращения напряженной электрохимической коррозии является использование антикоррозионных аддитивов или ингибиторов. Эти вещества добавляются в среду, с которой контактирует металл, и способны формировать защитную пленку на его поверхности. Такая пленка предотвращает процессы коррозии за счет увеличения электрического сопротивления между анодами и катодами. Антикоррозионные аддитивы могут быть использованы, например, при производстве масел и смазок, а также в системах охлаждения и отопления.
Также для предотвращения напряженной электрохимической коррозии может быть использован метод катодной защиты. Суть этого метода заключается в подключении к металлической конструкции анода из материала, более активного по отношению к коррозии, чем сам металл. Анодные материалы, такие как цинк или алюминий, будут корродировать вместо основного металла, что позволит сохранить его в неразрушенном состоянии. Этот метод широко используется в морской индустрии для защиты металлических конструкций от электрохимической коррозии в соленой воде.
Примеры практического применения знаний о электрохимической коррозии

Выбор материалов для строительства и производства
Изучение электрохимической коррозии помогает выбирать подходящие материалы для строительства и производства в различных условиях. Например, в морской среде, где присутствует высокая влажность и контакт с соленой водой, необходимо использовать материалы, устойчивые к коррозии, чтобы предотвратить разрушение конструкций. Знание электрохимической коррозии позволяет выбирать такие материалы, как нержавеющая сталь или алюминий с особыми покрытиями, которые обеспечивают защиту от коррозии.
Разработка и улучшение антикоррозионных покрытий
Исследования в области электрохимической коррозии применяются для разработки и улучшения антикоррозионных покрытий. Например, для защиты стали от коррозии разрабатываются покрытия, которые обладают барьерными свойствами и электрохимически защищают металл от контакта с окружающей средой. Понимание процессов, происходящих при электрохимической коррозии, позволяет создавать более эффективные и долговечные покрытия, что снижает эксплуатационные затраты и увеличивает срок службы материалов.
Прогнозирование и предотвращение коррозии в промышленных системах
Знание электрохимической коррозии позволяет прогнозировать и предотвращать коррозию в различных промышленных системах. Например, в нефтехимической отрасли, коррозия может привести к потере ценных материалов, авариям и остановке производства. Анализ электрохимических процессов позволяет определить основные причины коррозии и разработать стратегии для ее предотвращения, такие как использование катодной защиты, введение ингибиторов коррозии или регулярное контролирование состояния системы.
Оценка состояния и проведение инспекций
Знание электрохимической коррозии позволяет проводить оценку состояния металлических конструкций и проводить инспекции. Например, при осмотре мостов, трубопроводов или судов необходимо обнаруживать и оценивать уровень коррозии, чтобы принять меры по предотвращению аварийных ситуаций. Понимание электрохимических процессов позволяет проводить эффективные инспекции, определять уровень коррозии и прогнозировать возможные последствия в будущем.
Обучение и профессиональное развитие
Знание электрохимической коррозии важно для обучения и профессионального развития в области материаловедения, металлургии и инженерии. Понимание процессов, происходящих при коррозии, позволяет разрабатывать более эффективные и надежные конструкции, улучшать качество материалов и развивать методы защиты от коррозии. Знание электрохимической коррозии востребовано в различных отраслях промышленности, а также в научных исследованиях и разработках новых материалов и технологий.
Вопрос-ответ

Что такое электрохимическая коррозия металлов?
Электрохимическая коррозия металлов - это процесс разрушения металлических материалов под действием электролита и электрического тока, который вызывает окисление металла и образование коррозионной ржавчины.
Какие факторы влияют на электрохимическую коррозию металлов?
Факторы, влияющие на электрохимическую коррозию металлов, включают химическую природу металла и электролита, наличие кислорода, температуру, влажность и наличие других агрессивных веществ.
Какие металлы наиболее подвержены электрохимической коррозии?
Металлы различны по своей подверженности электрохимической коррозии. Некоторые металлы, такие как железо и сталь, особенно подвержены коррозии, в то время как другие, такие как золото и платина, имеют высокую устойчивость к коррозии.
Какие методы защиты от электрохимической коррозии металлов можно использовать?
Существует несколько методов защиты от электрохимической коррозии металлов, включая покрытия, антикоррозионные покрытия, катодную защиту, использование антикоррозионных материалов и контроль окружающей среды.
Какие последствия может иметь электрохимическая коррозия металлов?
Электрохимическая коррозия металлов может привести к снижению прочности и долговечности металлических конструкций, а также вызвать повреждение и выход из строя различных устройств и оборудования.
