Электрохимическая коррозия металлов является одной из наиболее распространенных проблем, с которыми сталкиваются инженеры и научные работники в различных отраслях промышленности. Она представляет собой процесс разрушения металла под воздействием равновесия химических реакций, происходящих на его поверхности в среде с определенными условиями.
Основными причинами электрохимической коррозии являются окисление металла и редукция окислителя. Реакция происходит в присутствии влаги и кислорода, а также в зависимости от конкретной среды, может включать другие факторы, такие как наличие солей или кислых или щелочных веществ.
Механизм электрохимической коррозии металлов представляет собой сложный процесс, который включает в себя несколько этапов. Первоначально металл подвергается окислению, высвобождая электроны, которые переносятся через электролит (среда) к катоду. Затем происходит редукция окислителя на катоде, что приводит к образованию продуктов коррозии.
Для предотвращения электрохимической коррозии металлов необходимо использовать специальные методы и технологии. Одним из них является применение защитных покрытий, таких как полимеры или покрытия на основе металлов, которые создают барьер между металлом и окружающей средой. Также важным методом является использование антикоррозионных пигментов, которые способствуют уменьшению окислительно-восстановительных реакций на поверхности металла.
Что такое электрохимическая коррозия металлов
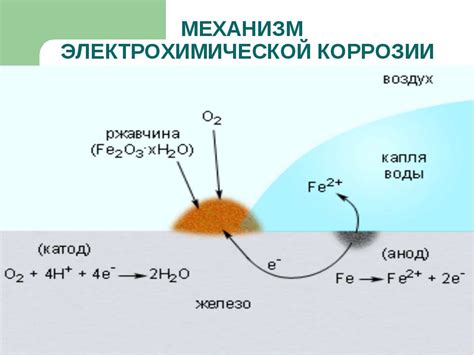
Электрохимическая коррозия металлов - это процесс разрушения металлических материалов под воздействием химических реакций, которые происходят в присутствии влаги и кислорода.
Основной механизм электрохимической коррозии металлов – это протекание анодных и катодных процессов. При этом, сам металл выступает в роли анода, на котором происходит окисление, а окружающая среда играет роль катода, где происходит восстановление.
Процесс коррозии особенно активно происходит при наличии электролита, такого как вода, соли или кислоты. Вода выполняет роль проводника электричества, а растворенные в ней примеси усиливают химические реакции.
Механизм электрохимической коррозии металлов можно представить в виде электрохимического цикла, где происходят последовательные процессы окисления и восстановления, вызывающие разрушение металла.
Для предотвращения электрохимической коррозии металлов используются различные методы, такие как нанесение защитных покрытий на поверхность металла, использование антикоррозийных добавок, а также контроль окружающей среды, в том числе поддержание оптимального уровня влажности.
Принципы электрохимической коррозии металлов

Электрохимическая коррозия металлов основана на особенностях химического взаимодействия металла с окружающей средой под воздействием электрического тока. Этот процесс происходит в результате разделения самого металла на аноды и катоды, где анодами являются поверхности, подверженные окислительным реакциям, а катодами – поверхности, участвующие в восстановительных реакциях.
Основным принципом электрохимической коррозии является наличие окислительного и восстановительного процессов, в которых участвуют металл и окружающая среда. На анодной поверхности металла происходит окисление металлических ионов, сопровождающееся выделением электронов и образованием ионов металла. Эти ионы переносятся в окружающую среду, образуя соединения металла с окислителем.
С другой стороны, на катодной поверхности окружающей среды происходит восстановление ионов металла с получением электронов, которые переносятся через электролит и поступают на анодную поверхность. При этом происходит обратное пермещение электронов и формирование обратной реакции восстановления вещества окружающей среды.
Таким образом, основным принципом электрохимической коррозии металлов является разделение металла на аноды и катоды, взаимодействие которых приводит к образованию ионов металла и соответствующих химических реакций. Понимание этих принципов позволяет разработать методы и способы предотвращения электрохимической коррозии и защиты металлических конструкций от разрушения.
Механизмы электрохимической коррозии металлов
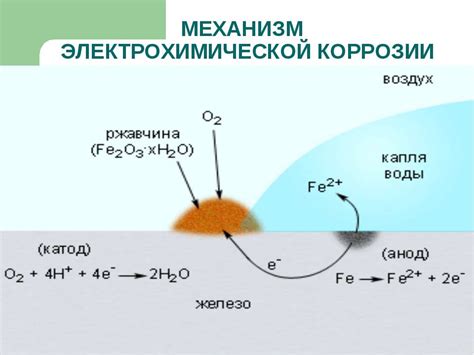
Электрохимическая коррозия металлов представляет собой процесс разрушения материала под воздействием окружающей среды. В основе этого процесса лежат различные механизмы, включая анодный и катодный процессы, а также миграцию ионов.
Анодный процесс является основным механизмом коррозии и заключается в окислении металла, когда он выступает в роли анода. В результате этого процесса происходит выделение электронов, которые передаются внешней цепи. При контакте с окружающей средой электроны восстанавливаются, приводя к образованию различных химических соединений. Таким образом, металл постепенно разрушается и образуется коррозионный продукт.
Катодный процесс является вспомогательным механизмом и заключается в протекании редокс-реакции на катоде. Катод обычно представляет собой окислитель, например, кислород из воздуха или вода. При этом происходит редукция воды или молекулярного кислорода, что ускоряет процесс коррозии.
Еще одним важным механизмом является миграция ионов, которая происходит в толще металла. Ионы могут перемещаться из одной точки в другую, что приводит к неравномерному разрушению материала. При этом образуются пустоты и трещины, которые способствуют дальнейшему проникновению вредных веществ и ускоряют процесс коррозии.
Для предотвращения электрохимической коррозии металлов применяются различные методы, включая использование защитных покрытий, создание промежуточного слоя, применение антикоррозионных добавок, контроль окружающей среды и другие. Основной принцип заключается в создании барьера между металлом и окружающей средой, который препятствует проникновению влаги, кислорода и других агрессивных веществ.
Методы предотвращения электрохимической коррозии металлов
Электрохимическая коррозия металлов – это процесс разрушения металлической поверхности под влиянием химических реакций с окружающей средой. Однако существуют различные методы, позволяющие предотвратить или снизить степень коррозии металлов и увеличить их срок эксплуатации.
Одним из методов предотвращения коррозии является использование защитных покрытий на металлической поверхности. Такие покрытия могут быть нанесены с помощью различных технологий, например, покрытие осуществляется путем окрашивания металла или нанесения слоя защитного материала. Такие покрытия служат преградой для воздействия окружающей среды на металлическую поверхность и помогают предотвратить коррозию.
Другим методом предотвращения электрохимической коррозии является использование анодной и катодной защиты. Анодная защита основана на том, что на поверхности металла создается гальваническая пара, которая направляет коррозионные процессы на анод и тем самым защищает металл от коррозии. Катодная защита, в свою очередь, заключается в подключении катодов к металлическим конструкциям, что позволяет снизить их потенциал и предотвратить коррозию.
Для предотвращения электрохимической коррозии также применяются ингибиторы коррозии. Ингибиторы – это вещества, добавляемые в среду взаимодействия металла с окружающей средой, благодаря которым уменьшаются скорость и степень коррозии. Они создают защитный слой на поверхности металла, который препятствует проникновению коррозионных сред в металл и позволяет снизить процесс коррозии.
Использование защитных покрытий для предотвращения коррозии металлов

Одним из наиболее эффективных методов предотвращения электрохимической коррозии металлов является использование защитных покрытий. Защитные покрытия могут быть нанесены на поверхность металла с целью создания преграды между металлической поверхностью и окружающей средой, что позволяет защитить металл от негативного воздействия агрессивных факторов, таких как влага, химические вещества и окислительные среды.
Существует большое количество различных видов защитных покрытий, которые могут быть использованы для предотвращения коррозии металлов. Одним из наиболее распространенных типов покрытий являются органические пленки, которые создают защитный барьер между металлом и окружающей средой.
Кроме органических пленок, существуют также неорганические покрытия, такие как оксидные пленки, фосфатные покрытия и многослойные композиционные покрытия. Оксидные пленки образуются при взаимодействии металла с агрессивной средой и обладают хорошей устойчивостью к коррозии.
Еще одним способом защиты металлов от электрохимической коррозии является использование антикоррозионных красок. Эти краски образуют плотное покрытие на поверхности металла, защищая его от воздействия агрессивных сред и долговременного воздействия влаги.
В целом, использование защитных покрытий является одним из наиболее эффективных методов предотвращения коррозии металлов. Выбор конкретного типа покрытия зависит от конкретной ситуации и условий эксплуатации. Однако, необходимо помнить, что защитные покрытия требуют правильного нанесения и регулярного обслуживания, чтобы обеспечить долговечность и эффективность защиты металлической поверхности.
Применение антикоррозионных добавок для улучшения защитных свойств металлов

Антикоррозионные добавки – это вещества или смеси, добавляемые в покрытия или растворы для улучшения их защитных свойств от электрохимической коррозии металлов. Они могут быть использованы как самостоятельно, так и в комбинации с другими антикоррозионными веществами.
Одним из основных механизмов действия антикоррозионных добавок является создание на поверхности металла защитной пленки. Эта пленка может быть формирована как благодаря реакции антикоррозионного вещества с поверхностью металла, так и путем ее физического закрепления на поверхности. В результате образования защитной пленки, металл становится менее доступным для контакта с окружающей средой и процесс коррозии замедляется или полностью прекращается.
Существует множество различных антикоррозионных добавок, применяемых в разных отраслях промышленности. Одним из наиболее распространенных типов антикоррозионных добавок являются ингибиторы коррозии. Это вещества, которые мешают химическим реакциям между металлом и реагентами окружающей среды. Ингибиторы коррозии могут быть добавлены в покрытия или используются в виде адгезивов для приклеивания пленок на поверхность металла.
Важно отметить, что выбор антикоррозионной добавки зависит от множества факторов, включая тип металла, условия эксплуатации и требования по защите металла от коррозии.
Другим способом улучшения защитных свойств металлов является использование композитных покрытий с наночастицами антикоррозионных добавок. Наночастицы обладают большой поверхностью в отношении своего объема, что позволяет им образовывать плотную и стабильную пленку на поверхности металла, предотвращая проникновение влаги и агрессивных веществ.
Таким образом, применение антикоррозионных добавок является одним из наиболее эффективных методов предотвращения электрохимической коррозии металлов. Добавки могут улучшить защитные свойства металлов путем создания защитной пленки или использования композитных покрытий с наночастицами. Важно выбирать правильную антикоррозионную добавку в зависимости от конкретных условий эксплуатации и требований по защите металла от коррозии.
Профилактические меры для предотвращения электрохимической коррозии металлов
Для предотвращения электрохимической коррозии металлов необходимо применять ряд профилактических мер, которые позволят уменьшить или вовсе исключить вероятность возникновения этого процесса.
Одной из основных мер является правильный выбор материала. Для изготовления конструкций и изделий, подверженных агрессивным средам, следует использовать металлы с высокой стойкостью к коррозии, такие как нержавеющая сталь, алюминий или титан. Эти материалы обладают пассивностью, то есть способностью образовывать защитную пленку на своей поверхности, что препятствует контакту с окружающей средой и предотвращает коррозию.
Также важным методом предотвращения электрохимической коррозии является защитное покрытие металлов. На поверхность металла наносят специальные защитные покрытия, которые создают барьер между металлом и агрессивным средой. Таким покрытием может быть лак, эмаль или антикоррозионное покрытие.
Для уменьшения скорости коррозионного процесса используются такие методы, как катодная защита и анодная защита. Катодная защита основана на подключении к металлу внешнего источника постоянного тока, который делает металл катодом и защищает его. Анодная защита, наоборот, подразумевает использование металла с наибольшей токсичностью как анода, чтобы он был подвержен коррозии вместо основного металла.
Очень важным аспектом в предотвращении электрохимической коррозии является регулярное техническое обслуживание. Необходимо проверять состояние конструкций, деталей и систем на предмет наличия признаков коррозии, а также осуществлять ремонт и замену поврежденных элементов.
Таким образом, соблюдение всех указанных профилактических мер позволяет эффективно предотвратить электрохимическую коррозию металлов и продлить срок их службы.
Вопрос-ответ

Что такое электрохимическая коррозия металлов?
Электрохимическая коррозия металлов - это процесс окисления металла, происходящий при наличии электролита и потенциальной разности между различными участками поверхности металла. В результате этого процесса металл превращается в соединения с окружающей средой, что приводит к разрушению материала.
Какие принципы лежат в основе электрохимической коррозии?
Основными принципами электрохимической коррозии являются анодный и катодный процессы. Анодный процесс – это процесс окисления металла, при котором участок металла переходит в раствор. Катодный процесс, напротив, является противоложным процессом, при котором растворитель переходит в металл. Разность потенциалов между анодом и катодом создает ток, который и вызывает наиболее активный анодный процесс и более пассивный катодный процесс.
Какие механизмы протекают при электрохимической коррозии металлов?
При электрохимической коррозии металлов протекают следующие механизмы: анодное растворение, катодное реакции и межфазные переносы. Анодное растворение представляет собой окисление металла и его переход в раствор. Катодные реакции - это редукция растворителя или другого вещества, происходящая на поверхности металла. Межфазные переносы являются процессом миграции ионов и молекул через границу между металлом и электролитом.
Какие методы существуют для предотвращения электрохимической коррозии металлов?
Существует несколько методов предотвращения электрохимической коррозии металлов. Один из них - это использование коррозионностойких сплавов и покрытий на поверхности металла. Также можно применять методы катодной и анодной защиты, при которых используются специальные аноды и катоды для предотвращения коррозии. Другие методы включают контроль окружающей среды, использование ингибиторов коррозии и регулярное обслуживание и очистку металлических конструкций.
