Электрохимическая коррозия – это процесс структурных изменений и разрушения металлов под влиянием химических реакций, которые возникают в результате их взаимодействия с окружающей средой. Этот процесс происходит на электроде, где происходит окисление атомов металла и одновременно восстановление некоторых других веществ. Отличительной чертой электрохимической коррозии является его связь с электрической энергией.
Причины и механизмы возникновения электрохимической коррозии металлов могут быть разнообразными. Одним из наиболее распространенных является контакт металла с влажной или соленой средой. Например, когда металл погружается в воду или находится в морской среде, происходит образование электроиндуктивной цепи, которая включает в себя металл, электролит и дополнительные составляющие, такие как включения и различные механические дефекты.
Другой причиной возникновения электрохимической коррозии является наличие анионного или катионного переноса в электролите. Это происходит, когда разные участки металла обладают различной степенью активности и происходит перемещение ионов под воздействием разницы в электропотенциале. Процессы межфазной миграции и растворения металла приводят к образованию пассивной пленки, что ускоряет разрушение металла.
Очень важно принимать меры для предотвращения электрохимической коррозии металлов, так как это явление может нанести значительный ущерб сооружениям, оборудованию и механизмам. Для этого применяются различные методы защиты: использование покрытий, катодной защиты, контроль концентрации кислорода и другие.
Причины и механизмы электрохимической коррозии металлов
Электрохимическая коррозия металлов - это процесс разрушения металлических поверхностей под воздействием электрохимических реакций. Причиной ее возникновения является наличие внешней среды, содержащей индивидуальные химически активные компоненты и воздействующей на поверхность металла.
Механизм электрохимической коррозии основан на протекании анодных и катодных реакций на металлической поверхности. На аноде происходит окисление металла, а на катоде происходит восстановление вещества, являющегося окислителем. Распространение коррозии происходит по металлической поверхности и вглубь материала.
Основными факторами, способствующими возникновению электрохимической коррозии, являются влага, кислоты и щелочи, соли и газы, а также температура окружающей среды. Влага является основным фактором, так как она обеспечивает проводность для протекания электрохимических реакций, а кислоты и щелочи ускоряют процесс окисления металла. Соли и газы, содержащиеся в воздухе или в среде, также могут вызывать коррозию металлических поверхностей. Температура окружающей среды влияет на скорость протекания реакций, так как при повышении температуры увеличивается активность атомов и молекул.
Влияние окружающей среды

Окружающая среда играет важную роль в степени электрохимической коррозии металлов. Различные факторы окружающей среды могут повлиять на скорость и интенсивность коррозии, вызывая ускоренное повреждение металла.
Одним из таких факторов является влажность окружающей среды. Вода, особенно если в ней содержатся различные растворенные ионные вещества, может стать активным агентом коррозии. Наличие электролитической среды позволяет проводить электрохимические реакции, которые приводят к процессу коррозии металла.
Также важным фактором является наличие кислотных или щелочных растворов в окружающей среде. Высокая кислотность или щелочность может стимулировать протекание коррозионных реакций, особенно если металл вступает в контакт с этими растворами на продолжительное время. Многие промышленные отходы и загрязнения окружающей среды содержат кислотные или щелочные вещества, что усиливает процесс коррозии.
Также следует отметить, что температура окружающей среды может существенно влиять на процесс коррозии металлов. При повышении температуры активность коррозии может значительно увеличиться. Это связано с повышенной реакционной способностью веществ и ионов в более высоких температурных условиях.
Другим фактором является наличие атмосферных загрязнений, таких как оксиды серы и азота. Они могут реагировать с металлом и способствовать возникновению коррозии. Особенно высокая концентрация загрязнений в промышленных зонах и городах может значительно повысить вероятность коррозии металлов.
Все вышеперечисленные факторы могут влиять на электрохимическую коррозию металлов и вызывать ее ускоренное развитие. Поэтому при проектировании и эксплуатации металлических конструкций необходимо учитывать особенности окружающей среды, в которой они будут находиться, и принимать меры по защите от воздействия этих факторов.
Электрохимические реакции

Электрохимические реакции являются основой для процессов коррозии металлов. Они происходят при взаимодействии металла с окружающей средой, где ключевую роль играют электрические и химические процессы.
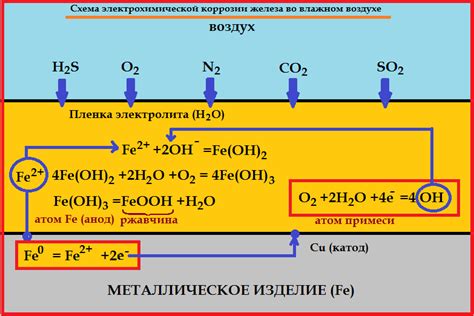
При контакте металла с влажным воздухом или жидкостью, образуются электролиты, то есть среды, способные проводить электрический ток. В этих условиях металл может стать анодом или катодом в электрохимической ячейке.
В электрохимической реакции анод – это участок металла, где происходит окисление, то есть потеря электронов. Катод – это участок металла или другого вещества, где происходит восстановление, то есть приобретение электронов. Электролит обеспечивает транспорт электронов между анодом и катодом.
При прохождении электрического тока через электрохимическую ячейку, происходит перенос заряда и образование различных реакционных продуктов. На поверхности анода металла происходит коррозия, сопровождающаяся растворением металла и образованием ионов. На поверхности катода могут образовываться разнообразные соединения, в зависимости от условий реакции.
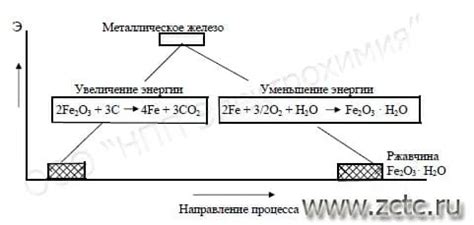
Один из наиболее распространенных механизмов электрохимической коррозии – это окислительно-восстановительные реакции, связанные с передачей электронов между анодом и катодом. Примером такой реакции является образование ржавчины на поверхности железа под воздействием кислорода и влаги.
Роль кислорода в коррозии

Кислород является одним из важных факторов, влияющих на возникновение и развитие электрохимической коррозии металлов. Он присутствует в окружающей среде и может вступать в реакцию с поверхностью металла, вызывая его разрушение.
Процесс коррозии начинается с адсорбции молекул кислорода из воздуха на поверхности металла. Однако сам кислород не обладает способностью нанести вред металлу без посредничества воды или влаги, что необходимо для его реакции с металлической поверхностью.
Когда вода или влага находится на поверхности металла, они образуют электролитическую среду, способствующую ионизации металла. Затем кислород вступает в реакцию с ионами металла, образуя оксидные соединения. Этот процесс называется окислением металла и является основной стадией электрохимической коррозии.
Окислительное действие кислорода на металл может быть усилено под действием других факторов, таких как наличие кислот или солей в электролитической среде. Кроме того, скорость коррозии зависит от концентрации кислорода, его давления и температуры окружающей среды.
Взаимодействие с ионами
Электрохимическая коррозия металлов происходит в результате взаимодействия металла с ионами в окружающей среде. Вода, растворы солей, кислоты и другие химические вещества могут содержать ионы, которые могут проводить электрический ток.
Кадо происходит взаимодействие металла с ионами? Когда металл погружается в раствор, происходит образование электрической двойной стенки. На поверхности металла образуется слой ионного химически активного металла (анода), а на поверхности раствора образуется слой ионного вещества, образующего вещество (катода). В данном случае, металл играет роль анода, а ионы раствора - роль катода.
В процессе коррозии ионы металла переходят из анода в катод, где происходит их восстановление. При этом атомы металла окисляются, теряют часть своих электронов и становятся положительно заряженными ионами. Ионы металла затем перемещаются через раствор, а электрический ток, образующийся в результате перемещения ионов, вызывает разрушение металла и образование коррозионных продуктов.
Роль температуры в электрохимической коррозии металлов
Температура играет значительную роль в процессах электрохимической коррозии металлов. Изменение температуры может значительно повлиять на скорость коррозионных реакций, а также на механизмы их возникновения.
При повышении температуры обычно увеличивается скорость коррозии металлов. Это связано с тем, что при более высоких температурах происходит активация реакций, а также ускорение диффузии реагентов к поверхности металла. Это приводит к усилению химических реакций, вызывающих разрушение металлической структуры.
Однако в некоторых случаях повышение температуры может привести к уменьшению скорости коррозии. Например, для некоторых металлов (например, алюминия) существует температурная точка, ниже которой скорость коррозии увеличивается, а выше которой уменьшается. Это связано с изменением механизмов передачи электронов и ионов при изменении температуры.
Также температура может влиять на рост и распространение коррозионных процессов. При повышении температуры может ускориться диффузия ионов внутри металла, что способствует распространению коррозии. Кроме того, высокая температура может способствовать изменению структуры поверхности металла и образованию защитной пленки, что может замедлить процессы коррозии.
Итак, температура играет важную роль в электрохимической коррозии металлов, влияя на скорость и механизмы коррозионных процессов. Понимание взаимосвязи между температурой и коррозией металлов позволяет эффективно контролировать и предотвращать коррозию в различных условиях эксплуатации.
Механизмы возникновения коррозии
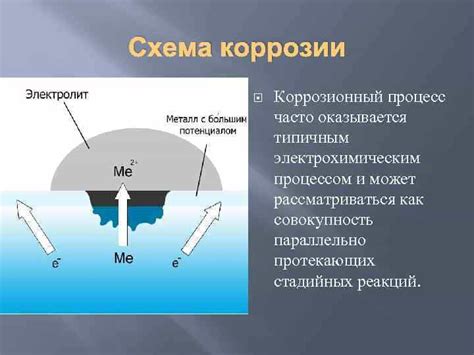
Коррозия металлов является процессом разрушения материала под воздействием окружающей среды. Возникновение коррозии связано с электрохимическими реакциями, происходящими на поверхности металла. Основными механизмами возникновения коррозии являются анодный и катодный процессы, а также протекание электролитических реакций.
В анодном процессе на поверхности металла происходит окисление, при котором атомы металла переходят в ионное состояние и уносят с собой электроны. Возникающие ионы металла мигрируют в окружающую среду и формируют осадок на поверхности металла или растворяются. Анодный процесс приводит к потере металла и появлению поверхностных дефектов.
В катодном процессе на поверхности металла происходит восстановление, то есть происходит поступление электронов из среды на поверхность металла. Катодный процесс компенсирует уход электронов в анодный процесс. Катодный процесс способствует сохранению металла и служит для снятия с поверхности металла электрических зарядов.
Протекание электролитических реакций влияет на скорость процесса коррозии. При этом, для протекания электролитических реакций необходимо наличие электролита, который может быть в виде влажной среды или раствора, окружающих металл. Электролитические реакции способствуют передаче электрического тока через электролит между анодом и катодом и ускоряют протекание коррозионных процессов.
Защита от электрохимической коррозии

Электрохимическая коррозия металлов является распространенной и серьезной проблемой, которая может приводить к разрушению конструкций и превращению ценных материалов в непригодные для использования образцы. Однако существуют различные способы защиты от электрохимической коррозии, которые позволяют минимизировать ее воздействие и продлить срок службы металлических изделий.
Один из основных методов защиты от электрохимической коррозии – это нанесение защитных покрытий на поверхность металла. Эти покрытия могут быть различного типа: органические (лаки, краски), неорганические (оксидные пленки, фосфаты, хроматы) или металлические (цинкование, оловление). Защитные покрытия эффективно защищают металл от воздействия агрессивных сред, предотвращают контакт металла с влагой и кислотными или щелочными растворами.
Другой метод защиты – это использование анодных или катодных защитных систем. Анодная защита состоит в подключении анода из цинка или алюминия к металлу, который нужно защитить. Это создает анодный электрический ток, который направляет коррозионные процессы на себя, предотвращая разрушение металла. Катодная защита, напротив, осуществляется путем подключения катода из металла с отрицательным потенциалом, который уменьшает скорость коррозии металла, подверженного коррозии.
Также можно применять защитные наплавочные покрытия, которые создаются путем наплавления специальных сплавов или порошков на поверхность металла. Эти покрытия обладают высокой адгезией и стойкостью к коррозии и механическим воздействиям. Они способны обеспечить долговечность металлических деталей и предотвратить их разрушение вследствие коррозии.
Вопрос-ответ

В чем заключается электрохимическая коррозия металлов?
Электрохимическая коррозия металлов - это процесс разрушения металла, вызванный химическими реакциями в контакте с окружающей средой и электролитом. В результате этого процесса, на поверхности металла образуются окисные пленки, которые приводят к его разрушению.
Какие факторы способствуют электрохимической коррозии?
Факторы, способствующие электрохимической коррозии металлов, включают в себя влажность, наличие кислорода, воздействие агрессивных сред, изменение pH окружающей среды, наличие электролитов (солей), а также различные повреждения на поверхности металла (трещины, царапины и т.д.).
Какие механизмы возникновения электрохимической коррозии известны?
Существует несколько механизмов возникновения электрохимической коррозии. Один из них - это анодная коррозия, когда на поверхности металла образуется окислительная среда, что приводит к его разрушению. Другой механизм - это катодная коррозия, когда одна часть металла выступает в роли катода, тогда как другая - в роли анода. Это приводит к перемещению электронов и разрушению металла.
Каковы причины развития электрохимической коррозии металлов?
Причины развития электрохимической коррозии металлов могут быть различными. Одной из главных причин является воздействие агрессивных сред, таких как кислоты, щелочи, соли и прочие химически активные вещества. Влажность и наличие кислорода также играют важную роль в процессе электрохимической коррозии. Повреждения на поверхности металла, такие как царапины, трещины, также могут способствовать развитию коррозии.
