Металлы в нашей жизни присутствуют повсеместно – они используются во многих отраслях промышленности и строительства, в производстве бытовой техники и электроники, в медицине и транспорте. Однако, металлы подвержены различным видам порчи, и одним из наиболее распространенных является электрохимическая коррозия.
Электрохимическая коррозия возникает при соприкосновении металла с электролитом – водой, воздухом, кислотами или солями. Эта реакция нежелательна и приводит к разрушению металлической структуры, что ведет к утрате функциональности и привлекательности изделий из металла. Электрохимическая коррозия особенно активизируется в условиях повышенной влажности, высоких температур и наличии кислорода.
Для защиты металлов от электрохимической коррозии разработаны различные методы и технологии. Одним из таких методов является использование покрытий, которые предотвращают проникновение агрессивных веществ к металлу, таких как краски, лаки, пластиковые покрытия или защитные покрытия, наносимые электрохимическими методами. Кроме того, применяют специальные сплавы, добавления или пропитку, которые увеличивают устойчивость металла к коррозии.
Электрохимическая коррозия металлов:

Электрохимическая коррозия металлов является процессом разрушения материала металла под влиянием агрессивных сред. Она происходит под воздействием электрохимических реакций между металлом, окружающей средой и электролитом.
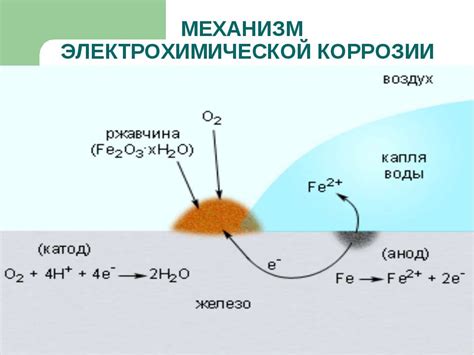
Причиной электрохимической коррозии являются различия в потенциалах электродов в среде, что приводит к возникновению гальванической пары между анодом и катодом. Анод — это область металла, где происходит окисление, а катод — место, где происходит восстановление.
Вред от электрохимической коррозии металлов может быть значительным. Она может вызывать значительные повреждения и деформацию конструкций из металла, а также снижать их прочностные и эксплуатационные характеристики. Коррозия также может приводить к ухудшению качества материалов и повреждению покрытий.
Защита от электрохимической коррозии металлов может быть достигнута различными методами. Один из них — использование покрытий из антикоррозионных материалов, таких как краски, пленки или металлические покрытия. Другой метод — применение антикоррозионных добавок, которые формируют защитную пленку на поверхности металла. Также эффективным методом является применение анодной защиты, при которой металл становится катодом, а анодом выступает другой материал.
Понятие и причины

Электрохимическая коррозия – это процесс разрушения материала под воздействием химических реакций и электрического тока. В основе коррозии лежит реакция металла с окружающей средой, которая приводит к образованию новых веществ.
Основной причиной электрохимической коррозии является контакт металла с влажной или агрессивной средой. Влага содержит растворенные газы и соли, которые способны проводить электрический ток и вызывать химические реакции. Это приводит к возникновению различных коррозионных процессов.
Металлические образцы изготавливаются из сплавов, которые часто содержат различные элементы. Разность в составе сплава может привести к возникновению электрохимических реакций и коррозии при контакте с внешней средой. При этом участки сплава могут выступать в роли катода и анода, что усиливает процесс коррозии.
Другой причиной электрохимической коррозии является наличие местных дефектов или поверхностных покрытий на металле. Если на поверхности есть царапины, трещины или неровности, то это может служить местом локализации коррозионных процессов. Поверхностные покрытия, такие как краска или защитные покрытия, могут образовывать барьер между металлом и окружающей средой, но при повреждении они становятся источником ускоренной коррозии.
Вред от электрохимической коррозии
Электрохимическая коррозия металлов является одной из наиболее распространенных и разрушительных форм коррозии. Она может приводить к серьезным повреждениям и потере функциональности металлических изделий и конструкций.
Одной из основных опасностей, связанных с электрохимической коррозией, является потеря механической прочности металла. Коррозионный процесс приводит к появлению трещин и деформации металлической структуры, что может привести к разрушению изделия или конструкции.
Кроме того, электрохимическая коррозия может вызывать утечку опасных веществ. Например, при коррозии металлических емкостей, содержащих химические реагенты или вредные вещества, могут образовываться утечки, что представляет угрозу для здоровья и безопасности окружающей среды.
Вред от электрохимической коррозии также проявляется в экономическом плане. Потери, связанные с заменой или ремонтом поврежденных металлических изделий и конструкций, могут быть значительными. Кроме того, коррозия может привести к прерыванию работы технических систем и оборудования, что также влечет за собой значительные финансовые потери.
В целях защиты от вредоносных последствий электрохимической коррозии необходимо проводить регулярное обслуживание и проверку состояния металлических изделий и конструкций. Также применяются различные методы защиты от коррозии, такие как антикоррозионное покрытие, использование коррозионностойких материалов и защитные покрытия.
Основные методы защиты
Для защиты от электрохимической коррозии металлов при соприкосновении с другими материалами существуют различные методы. Эти методы могут быть разделены на пассивные и активные.
Пассивные методы защиты основываются на создании защитной пленки на поверхности металла, которая предотвращает контакт с агрессивными средами. Одним из таких методов является покрытие металла защитным слоем. Это могут быть различные покрытия, такие как краска, лак или пластиковая пленка. Также широко используется нанесение слоя катодной защиты на поверхность металла, который состоит из ингибиторов коррозии.
Активные методы защиты направлены на изменение условий окружающей среды, чтобы предотвратить возникновение коррозии. Один из самых распространенных активных методов - контроля электрического потенциала металла. Для этого используются специальные устройства, такие как анодные защитные системы, которые подключены к металлической конструкции и поддерживают ее потенциал на определенном уровне, предотвращая тем самым коррозию.
Другим активным методом защиты от электрохимической коррозии является использование катодной защиты. При этом, на поверхность металла подается электрический ток, который способствует образованию катодного слоя и защищает металл от коррозии. Этот метод широко применяется для защиты подводных и наземных металлических конструкций.
Также для защиты от электрохимической коррозии металлов при соприкосновении используются специальные протекторы и антикоррозионные покрытия. Эти методы защиты направлены на создание дополнительной защитной пленки на поверхности металла и предотвращение проникновения агрессивных веществ.
Итак, основные методы защиты от электрохимической коррозии металлов при соприкосновении включают пассивные методы (покрытия, катодная защита) и активные методы (контроль электрического потенциала, катодная защита). Каждый из этих методов имеет свои преимущества и недостатки, и выбор метода зависит от условий эксплуатации и характеристик металлических конструкций.
Антикоррозионные покрытия

Антикоррозионные покрытия - это специальные устойчивые к коррозии слои, которые наносятся на поверхность металла для защиты от окисления и разрушения. Данные покрытия играют ключевую роль в борьбе с электрохимической коррозией металлов при соприкосновении с другими материалами.
Существует несколько типов антикоррозионных покрытий, которые применяются для различных целей и на разных поверхностях металла. Одним из наиболее распространенных типов покрытий является органическое покрытие, которое состоит из полимерных материалов. Оно создает защитную пленку на металлической поверхности, предотвращая проникновение влаги и кислорода, что уменьшает риск коррозии.
Кроме органических покрытий, существуют также неорганические покрытия, такие как цинковые и алюминиевые. Они часто используются на стальных конструкциях, таких как мосты и здания, благодаря своей высокой стойкости к коррозии. Цинковое покрытие, например, образует защитную слой оксида цинка, который создает барьер для влаги и кислорода.
Кроме того, существуют и другие специализированные антикоррозионные покрытия, которые используются в определенных отраслях. Например, в морской индустрии применяются покрытия с высокой солевой стойкостью для защиты от агрессивной морской среды. В автомобильной промышленности используются покрытия, обладающие высокой стойкостью к механическим воздействиям.
Выбор антикоррозионного покрытия зависит от многих факторов, таких как условия эксплуатации, тип металла, его область применения и требования к эстетическому внешнему виду. Однако, независимо от выбранного покрытия, его применение является неотъемлемой частью процесса защиты металлов от электрохимической коррозии.
Ингибиторы коррозии

Ингибиторы коррозии – это вещества или соединения, добавляемые в среду контакта металла с агрессивной средой для уменьшения скорости коррозионного процесса. Они оказывают защитное действие, формируя на поверхности металла плёнку, которая препятствует проникновению агрессивных факторов и уменьшает окислительно-восстановительные процессы.
Ингибиторы коррозии могут быть органическими или неорганическими веществами. Органические ингибиторы образуют на поверхности металла тонкую защитную плёнку, содержащую преимущественно органические кислоты, аминокислоты или их соли. Неорганические ингибиторы, в основном, образуют на поверхности металла плёнку металлических оксидов или солей.
Преимущества использования ингибиторов коррозии:
- Снижение скорости коррозионного процесса;
- Увеличение срока службы металлических конструкций;
- Увеличение эффективности защитных покрытий;
- Снижение затрат на ремонт и замену корродировавших металлических деталей.
Для выбора оптимального ингибитора коррозии необходимо учитывать ряд факторов, таких как состав и характеристики агрессивной среды, свойства металла, условия эксплуатации и т.д. Нередко используются комбинированные системы ингибиторов, которые позволяют достичь наилучших результатов в защите металлов от коррозии.
Катодная защита

Катодная защита - один из эффективных методов борьбы с электрохимической коррозией металлов при их соприкосновении. Она заключается в создании условий, при которых металлы становятся катодами и прекращается их коррозия.
Основной принцип работы катодной защиты заключается в подключении к металлическому объекту сопротивления, но с большим диапазоном пассивационного потенциала, как это делает самый железохромовый катод. Использование такого материала позволяет создать разность потенциалов таким образом, что металлический объект становится катодом и уже не образуются коррозионные гальванические элементы.
Катодная защита широко применяется в промышленности для защиты не только металлических конструкций, но и подводных трубопроводов, судов, плавучих доков, буровых установок и других объектов, которые подвержены коррозии из-за соприкосновения с морской водой, почвенной влагой или другими агрессивными средами.
Основным достоинством катодной защиты является ее долговечность и надежность. Этот метод позволяет значительно увеличить срок службы металлических конструкций и уменьшить затраты на их эксплуатацию и ремонт. Катодная защита также не требует больших затрат на обслуживание и контроль, что делает ее эффективным и экономически выгодным методом защиты от коррозии.
Если рассматривать катодную защиту с точки зрения окружающей среды, то можно отметить, что она является экологически безопасным методом. При его использовании не требуется использовать химические реагенты или токсичные вещества. Это позволяет сохранить природные ресурсы и уменьшить негативное влияние на окружающую среду.
Электролитическая защита

Электролитическая защита является одним из эффективных методов борьбы с электрохимической коррозией металлов при соприкосновении. Она основана на применении электрического тока для подавления коррозионных процессов.
Принцип работы электролитической защиты заключается в создании на поверхности металла защитного слоя, состоящего из нерастворимого соединения металла. Для этого на металлическую поверхность наносят слой электролита, содержащего соединение, способное осаждаться на поверхности металла при пропускании через него электрического тока.
В процессе электролитической защиты используются два электрода: основной и вспомогательный. Основной электрод представляет собой металл, который нужно защитить от коррозии. Вспомогательный электрод может быть выполнен из инертного материала, например, платины или карбоната. Он служит для создания электрического потенциала, способного протекать через электролит и активизировать процесс осаждения защитного слоя на поверхности основного электрода.
Основными компонентами системы электролитической защиты являются источник постоянного тока и контроллер электролиза, обеспечивающий поддержание необходимых параметров процесса. Источник постоянного тока устанавливает напряжение и ток, необходимые для процесса электролиза, а контроллер электролиза осуществляет регулировку этих параметров в зависимости от условий эксплуатации.
Преимуществами электролитической защиты являются ее высокая эффективность, низкая стоимость эксплуатации и возможность применения для защиты различных металлических конструкций и оборудования. Этот метод широко используется в промышленности, строительстве и транспорте для предотвращения коррозии и увеличения срока службы металлических изделий.
Вопрос-ответ

Как происходит электрохимическая коррозия металлов?
Электрохимическая коррозия металлов происходит при соприкосновении металлической поверхности с электролитом (обычно влагой). При этом возникают гальванические элементы, состоящие из анода (металла, который теряет электроны) и катода (металла, который принимает электроны). В результате анодный металл окисляется, а его электроны переходят на катодный металл, вызывая его восстановление. Этот процесс приводит к разрушению металлической поверхности и образованию коррозии.
Какие металлы подвержены электрохимической коррозии?
В основном, электрохимическая коррозия возникает у металлов, которые обладают разными электрохимическими свойствами. Например, если металлы разные по электрохимическому потенциалу, то они могут образовывать гальваническую пару и вызывать коррозию. Также коррозию могут вызывать различные металлические сплавы, где металлы имеют разные свойства и реакции на воздействие электролитов.
