Электрохимическая коррозия металлов является одной из наиболее распространенных и разрушительных форм их деградации. Термин "коррозия" означает химическое разрушение металла, вызванное взаимодействием с окружающей средой. Электрохимическая коррозия - это один из основных механизмов, через который происходит декомпозиция металлических материалов и конструкций.
Механизм образования электрохимической коррозии металлов связан с протеканием электрохимических реакций на поверхности металла. При коррозии металла происходит перенос электронов и ионов между различными участками поверхности, что приводит к появлению разности потенциалов. В результате этого процесса в металле образуются две зоны: активная и пассивная. В активной зоне электрохимические реакции протекают в направлении коррозии, а в пассивной зоне они протекают в направлении образования защитной пленки.
Причины возникновения электрохимической коррозии металлов могут быть различными. Одной из основных причин является контакт металла с агрессивной средой, такой как вода, влажность, кислоты, щелочи, соли и другие химические вещества. Эти вещества активно взаимодействуют с поверхностью металла, приводя к его разрушению. Также важным фактором является наличие разности потенциалов между различными участками поверхности металла, что стимулирует протекание электрохимических реакций.
В дальнейшем рассмотрим более подробно механизмы и причины возникновения электрохимической коррозии металлов, а также методы ее предотвращения.
Сущность электрохимической коррозии

Электрохимическая коррозия – это процесс разрушения металлических материалов под воздействием химических реакций, которые происходят при контакте с окружающей средой. Однако коррозия не является случайным процессом, а основана на электрохимических принципах.
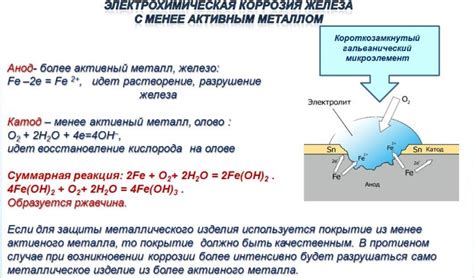
Основным механизмом электрохимической коррозии является процесс окисления и восстановления металлов. При этом металл выступает в роли анода и подвергается окислению, а окружающая среда или другой металл – в роли катода и восстанавливается. Таким образом, происходит токовый процесс, при котором происходит перенос электронов и ионов через электролитическую среду.
Для того чтобы коррозия могла протекать, необходимо наличие трех основных компонентов: металла, электролитической среды и кислорода. Металл выступает в роли анода и подвергается электрохимическим процессам, на которых основана коррозия. Электролитическая среда обеспечивает проводность ионов, необходимую для переноса электрического заряда. А кислород является активным агентом, участвующим в процессе окисления металла.
Основной причиной возникновения электрохимической коррозии является разность потенциалов между различными участками металла. Такая разность потенциалов создает условия для возникновения электрохимических реакций и переноса зарядов через электролитическую среду. Кроме того, факторы, такие как содержание влаги, агрессивных химических веществ и температура, также могут существенно повлиять на скорость и интенсивность коррозии.
Механизм образования коррозии
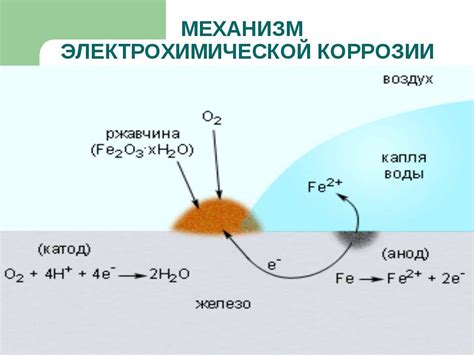
Электрохимическая коррозия металлов представляет собой процесс разрушения металлической поверхности под влиянием химической реакции с окружающей средой. Основной механизм образования коррозии состоит из нескольких этапов.
Первый этап – адсорбция активных ионов окислителя на поверхность металла. Это происходит из-за разности электрохимических потенциалов между металлом и окружающей средой. Активные ионы окислителя проникают через защитную пленку на поверхности металла и адсорбируются на его поверхности.
Второй этап – реакция между активными ионами окислителя и ионами металла. В результате этой реакции образуются оксидные соединения металла, которые образуют твердую коррозионную пленку на поверхности металла.
Третий этап – диссоциация влаги в окружающей среде и проникновение влаги через твердую коррозионную пленку на поверхность металла. Вода служит ионным проводником и ускоряет процесс реакции между окислителем и металлом.
Четвертый этап – продолжение химической реакции на поверхности металла, вызывающей дальнейшее разрушение его поверхности. Таким образом, процесс образования коррозии является автокаталитическим, то есть происходящий процесс активирует и усиливает сам себя.
Итак, электрохимическая коррозия металлов является сложным процессом, который включает в себя несколько этапов, начиная от адсорбции активных ионов окислителя на поверхность металла и заканчивая разрушением металлической поверхности. Причины возникновения коррозии металлов могут быть разнообразными, включая механические повреждения, химическое воздействие различных веществ и присутствие электролитов в окружающей среде.
Роль электролита в процессе коррозии
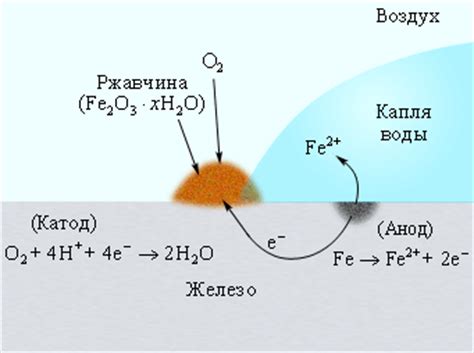
В процессе электрохимической коррозии металлов электролит играет важную роль. Электролит представляет собой раствор, который содержит положительно и отрицательно заряженные ионы. Он обеспечивает наличие свободных ионов, которые могут перемещаться и участвовать в реакции коррозии металла.
При наличии электролита на поверхности металла происходит электрохимическая реакция, состоящая из двух основных процессов: окисления и восстановления. Когда металл окисляется, он переходит в ионное состояние и освобождает электроны, которые переносятся через электролит к положительно заряженному металлическому предмету, который является анодом. Тем самым металл приобретает положительный заряд.
Вместе с этим в электролите образуется металлоокислительное вещество, которое принимает электроны и редуцируется. Это вещество превращается в отрицательно заряженные ионы, которые перемещаются через электролит к металлическому предмету с положительным зарядом, который является катодом. Здесь ионы восстанавливаются, возвращаясь к своему нейтральному состоянию.
Таким образом, электролит содействует перемещению ионов и электронов, создавая потенциал для протекания электрохимической реакции коррозии металла. От состава электролита и его свойств зависит скорость протекания процесса коррозии. Например, если электролит содержит противоположные по знаку ионы, такие как хлор и гидроксид, то образование гидроксида металла может снижать скорость коррозии.
Влияние металлической структуры на коррозию
Металлы имеют различную кристаллическую структуру, которая может влиять на их способность к коррозии. Одной из основных характеристик металлической структуры является зернистость, то есть наличие зерен различной ориентации кристаллической решетки.
Влияние зернистости на коррозию обусловлено различием в электрохимических свойствах зерен, таких как потенциалы коррозии и скорости анодных и катодных реакций. Неравномерное распределение этих свойств в зернах может привести к местным анодно-катодным процессам и образованию коррозионных фокусов.
Кроме того, на предельные дефекты металлической структуры, такие как границы зерен и межфазные границы, могут оказывать значительное влияние на процессы коррозии. По границам зерен могут протекать особенно интенсивные процессы, связанные с дефектными участками структуры. Наличие межфазных границ также может способствовать развитию коррозии, особенно в условиях влажности и наличия агрессивных компонентов среды.
Таким образом, металлическая структура является важным фактором, определяющим способность металла к коррозии. При проектировании и выборе материалов необходимо учитывать технологический процесс и условия эксплуатации, чтобы минимизировать риск коррозионных повреждений.
Факторы, влияющие на начало коррозии металлов
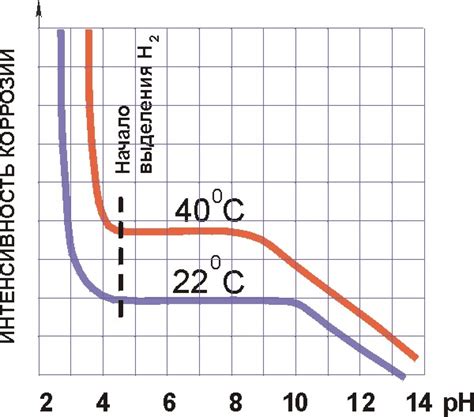
Электрохимическая коррозия металлов - это процесс разрушения материала под воздействием окружающей среды, особенно влаги или растворов, при наличии электролита и электрической проводимости.
Существует ряд факторов, которые могут оказывать влияние на начало коррозии металлов.
1. Электрический потенциал
Различные материалы обладают различными электрическими потенциалами, которые могут влиять на скорость коррозии. Если два или более различных металлов находятся в контакте с электролитом, может произойти гальваническая коррозия, при которой металл с более высоким электрическим потенциалом является анодом и подвергается коррозии.
2. Температура
Повышение температуры окружающей среды может увеличить скорость коррозии металла, так как это способствует увеличению химических реакций между металлом и окружающей средой. Высокая температура также может способствовать образованию пассивной поверхностной пленки, которая защищает металл от коррозии.
3. Химическая составляющая
Химические соединения в окружающей среде, такие как соли или кислоты, могут значительно ускорить процесс коррозии металлов. Особенно агрессивными являются хлориды, которые способны проникать в металлическую структуру и вызывать деградацию материала.
4. Присутствие кислорода
Наличие кислорода является одним из ключевых факторов, влияющих на начало электрохимической коррозии металлов. Кислород может реагировать с электролитом и металлом, образуя окисные пленки и активируя процесс разрушения металлической структуры.
5. Механическая обработка
Внутренние напряжения, вызванные механической обработкой металла, могут увеличить предрасположенность материала к коррозии. Это связано с заметным изменением металлической структуры и повышением площади поверхности, доступной для взаимодействия с окружающей средой.
Учет и контроль этих факторов может помочь в предотвращении или замедлении электрохимической коррозии металлических конструкций и оборудования, увеличивая их срок службы.
Химические реакции, протекающие при коррозии
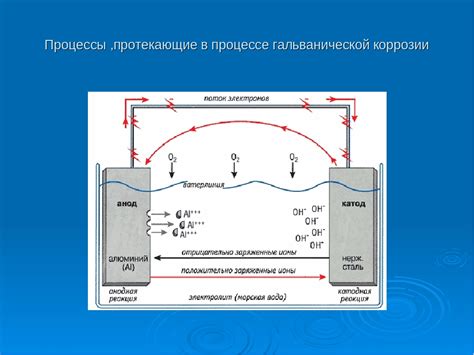
Коррозия металлов – это процесс их поверхностного разрушения под действием окружающей среды. Этот процесс осуществляется через химические реакции, которые протекают на поверхности металла.
Основной механизм коррозии металлов – это окислительно-восстановительные реакции. Для того чтобы понять, как происходит коррозия, необходимо знать, что каждый металл имеет определенное электрохимическое потенциал. Электрохимический потенциал – это способность металла отдавать или принимать электроны. Когда два разных металла находятся в контакте в присутствии электролита (например, вода) происходит перенос электронов между ними, который сопровождается окислительно-восстановительными реакциями.
При коррозии металлов на поверхности металла образуется оголенная зона, в результате чего происходит реакция окисления этой зоны и реакция восстановления других металлов, находящихся в контакте с этой зоной.
В результате этих химических реакций на поверхности металла образуются новые соединения, которые называются коррозионными продуктами. Коррозионные продукты обычно имеют другую структуру и свойства, поэтому они не обладают защитно-конструктивными функциями и ускоряют процесс разрушения металла.
Как видно из описанных химических реакций, коррозия металлов – это сложный процесс, в котором протекают различные химические превращения. Понимание этих реакций позволяет разработать методы и способы защиты от коррозии, что является важной задачей в современной инженерии и промышленности.
Примеры электрохимической коррозии в быту и промышленности
Электрохимическая коррозия является широко распространенным процессом, который может наблюдаться как в быту, так и в промышленности. Ниже приведены несколько примеров данного явления.
Примеры коррозии в быту:
- Коррозия железных изделий в ванной комнате. В результате воздействия воды и влажности, на поверхности металлических предметов, таких как дверные ручки или краны, может образовываться ржавчина.
- Коррозия алюминиевых конструкций. Алюминиевые рамы окон или дверей подвержены коррозии, особенно в местах, где происходит контакт с влагой или другими металлами.
- Коррозия медных трубопроводов. Медные трубы, используемые для водопровода и отопления, могут подвергаться коррозии из-за воздействия химических веществ, находящихся в воде или воздухе.
Примеры коррозии в промышленности:
- Коррозия металлических конструкций в солевой промышленности. В солевых шахтах и производствах соли, металлические конструкции, такие как поддоны или трубы, могут подвергаться коррозии из-за воздействия высокой концентрации солей.
- Коррозия оборудования в нефтяной промышленности. Все оборудование, находящееся в контакте с нефтью или нефтепродуктами, подвержено коррозии, особенно в условиях высокой температуры и влажности.
- Коррозия металлических конструкций в окружающей среде. В промышленных районах с высоким концентрацией загрязняющих веществ в воздухе и воде металлические конструкции, такие как здания или мосты, могут подвергаться коррозии.
Вопрос-ответ

Что такое электрохимическая коррозия металлов?
Электрохимическая коррозия металлов — это процесс разрушения металлической поверхности под воздействием химических реакций с окружающей средой и электрических токов.
Каков механизм образования электрохимической коррозии металлов?
Механизм образования электрохимической коррозии металлов основан на протекании электрохимических реакций на поверхности металла, связанных с окислением металла и редукцией веществ из окружающей среды.
