Электрохимическая коррозия является одной из наиболее распространенных проблем, связанных с использованием металлических материалов, таких как железо и сталь. Коррозия представляет собой процесс, в результате которого металлы подвергаются разрушительному воздействию окружающей среды, приводящему к их постепенному разложению. Основным механизмом коррозии является электрохимический процесс, в котором металлическая поверхность выступает в качестве анода или катода.
Коррозия возникает из-за разницы потенциала на различных участках металлической поверхности, что приводит к тому, что один участок становится анодом, а другой - катодом. При этом электролит, такой как вода или раствор, играет роль проводника, обеспечивая поток электронов между анодом и катодом. В результате этого происходит процесс окисления металла на аноде и процесс восстановления на катоде.
Принцип работы гальванического элемента основан на принципе электролиза, который возникает при электрохимической коррозии. Гальванический элемент состоит из двух различных металлов, погруженных в электролит (часто это раствор кислоты или соли) и соединенных проводом. Один из металлов, который имеет более низкую электрохимическую активность, называется анодом, а другой металл, который имеет более высокую активность, - катодом.
В процессе работы гальванического элемента на аноде происходит окисление металла, при котором образуются электроны и ионы. Электроны перемещаются по проводу к катоду, где происходит процесс восстановления металла с поглощением ионов. Таким образом, гальванический элемент создает потенциалное напряжение между анодом и катодом, и может использоваться для преобразования химической энергии в электрическую энергию.
Электрохимическая коррозия металлов

Электрохимическая коррозия металлов - это процесс, при котором металлическая поверхность подвергается разрушению под воздействием электрохимических реакций. Коррозия является серьезной проблемой для различных отраслей, таких как строительство, автомобильная промышленность и судостроение, так как она приводит к снижению прочности и технических характеристик металлов.
Основой электрохимической коррозии является присутствие электролита, который может быть в виде влажной среды или раствора. Когда металл погружается в электролит, образуется анод и катод, и между ними возникает электрический потенциал, что приводит к потенциалу коррозии.
В процессе электрохимической коррозии происходит окисление металлической поверхности анодом, а на катоде происходит протекание редокс-реакций, в результате которых электроны переносятся с анода на катод через электролит. Это приводит к образованию продуктов коррозии, таких как оксиды металла или гидроксиды, которые могут быть видны на поверхности металла в виде ржавчины или других осадков.
Для предотвращения электрохимической коррозии применяются различные методы, такие как использование коррозионностойких покрытий, применение антикоррозионных добавок к материалам, проведение катодной защиты и использование гальванических элементов. Гальванический элемент состоит из двух или более металлов, которые подключены к электролиту и создают электрический потенциал, который предотвращает коррозию металлов.
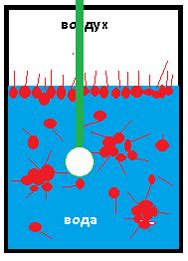
Процесс коррозии металлов воздействием влаги и кислорода

Коррозия металлов является процессом, при котором металлические материалы разрушаются под воздействием влаги и кислорода. Этот процесс является неизбежным и может привести к серьезным последствиям для металлических конструкций и изделий.
Как только металл контактирует с влажным окружающим воздухом, начинается процесс окисления. Кислород из воздуха реагирует с поверхностью металла, образуя окисные пленки, которые приводят к разрушению материала. Вода играет роль электролита, способствуя проведению электрических зарядов и ускоряя процесс коррозии.
Одним из факторов, влияющих на скорость коррозии металлов, является концентрация кислорода в воздухе. Чем больше кислорода, тем более интенсивно протекает окисление металла. Кроме того, на процесс коррозии влияют температура, влажность и наличие примесей в воде и воздухе.
Коррозия металлов приводит к ухудшению их физических и механических свойств. Металл становится хрупким, теряет прочность и может легко ломаться. Кроме того, коррозия может привести к потере эстетического вида металлических изделий.
Для защиты металлов от коррозии применяют различные методы, такие как покрытие металла защитными слоями, использование антикоррозионных покрытий, применение специальных покрытий и лаков, а также гальванические методы защиты.
Влияние электролитов на скорость коррозии

Скорость коррозии металлов в значительной мере зависит от свойств электролитов, находящихся в контакте с металлической поверхностью. Электролиты могут ускорять или замедлять процесс электрохимической коррозии в зависимости от их состава и концентрации.
Высокая концентрация коррозионно-активных веществ в электролите способствует увеличению скорости коррозии. Например, вода с содержанием растворенных солей может быть более агрессивной к металлам, чем дистиллированная вода. Частыми причинами повышенной концентрации коррозионных веществ являются загрязнения, наличие растворенных газов и микроорганизмов.
Однако существуют и такие электролиты, которые могут замедлить процесс коррозии металлов. Они создают на поверхности металла защитную пленку, которая препятствует дальнейшему разрушению материала. Такие электролиты могут быть добавлены специально или образовываться в процессе работы устройства. Примером может служить различная масляная среда, окрашенные электролиты и другие специальные составы.
Также следует отметить, что возможны случаи, когда некоторые электролиты оказывают двойственное влияние на скорость коррозии. Они могут как ускорять, так и замедлять процесс разрушения металла в зависимости от различных факторов, таких как pH-уровень или наличие других веществ в растворе.
В целом, выбор электролита играет важную роль при проектировании и эксплуатации гальванических элементов и других электрохимических систем. Необходимо учитывать его состав, концентрацию и свойства, чтобы достичь требуемой скорости коррозии и обеспечить долговечность и надежность металлических конструкций.
Принцип работы гальванического элемента
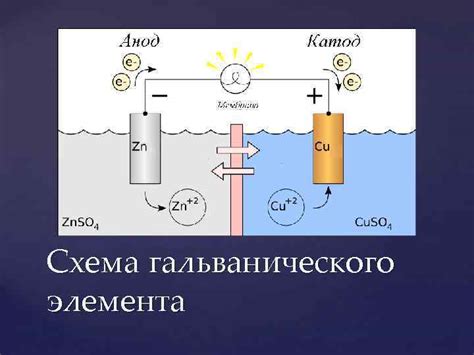
Гальванический элемент – это устройство, преобразующее химическую энергию в электрическую. Основное принцип действия гальванического элемента заключается в том, что при взаимодействии различных металлов с электролитами возникает разность потенциалов. Источником этой разности потенциалов является химическая реакция, происходящая между металлами и электролитами.
Процесс работы гальванического элемента включает два основных процесса – окисление и восстановление. При окислении одного металла или его ионов происходят электронные переходы, при которых электроны покидают поверхность металла и перемещаются в электролит. Это происходит благодаря реакции окисления. Восстановление происходит на поверхности другого металла, где происходит процесс принятия электронов их электролитом. Это происходит благодаря реакции восстановления.
В результате этих процессов формируется электрический ток, который может быть использован для питания электрических устройств или зарядки аккумуляторов. Потребителем этого тока может быть лампа, двигатель или другое устройство, которое преобразует электрическую энергию в другие виды энергии.
Принцип работы гальванического элемента основан на способности разных металлов взаимодействовать с электролитами и разделяться на окисленные и восстановленные компоненты. Важно подбирать металлы и электролиты таким образом, чтобы образуемая разность потенциалов была достаточно большой для создания электрического тока и энергии.
Процесс переноса электронов между анодом и катодом
Электрохимическая коррозия металлов и принцип работы гальванического элемента неразрывно связаны с процессом переноса электронов между анодом и катодом. Анод - это металлическая область, где происходит окисление, а катод - место, где электроны принимаются, что обусловливает восстановление
В электрохимической реакции происходит перемещение электронов от атомов металла на аноде к атам металла на катоде. Этот процесс осуществляется через электролит, который является разделительным слоем между анодом и катодом. Электролит может быть жидким или твердым веществом, имеющими свободные ионы, которые позволяют проводить электрический ток.
Анод - место окисления, где металл переходит из нейтрального состояния в ионы, отдавая свои электроны в электролит. Катод - место восстановления, где ионы металла восстанавливаются обратно в нейтральное состояние, принимая электроны от электролита.
Процесса переноса электронов между анодом и катодом важен для понимания электрохимической коррозии металлов. При наличии электролита и электрического контакта между анодом и катодом образуется электрическая цепь. Это позволяет электронам двигаться от анода к катоду и проводить электрический ток, что в последствии приводит к потере металла на аноде и осаждению на катоде.
Функция электролита в гальванической системе
Электролит – это вещество или раствор, способное проводить электрический ток. В гальванической системе электролит играет важную роль, обеспечивая проводимость электронов и ионов между электродами и поддерживая равенство концентраций ионов в растворе. Функции электролита в гальванической системе связаны с различными процессами, происходящими на электродах и в растворе.
Во-первых, электролит обеспечивает проводимость электронов между анодом и катодом. В процессе окисления на аноде освобождаются электроны, которые двигаются через электролит к катоду, где происходит процесс восстановления. Благодаря проводимости электролита, электроны могут переноситься от анода к катоду, создавая электрический ток.
Во-вторых, электролит играет роль переносчика ионов, необходимых для процессов окисления и восстановления на электродах. Ионы из электролита перемещаются к аноду или катоду, участвуя в реакциях электрохимического процесса. Кроме того, электролит поддерживает равенство концентраций ионов в растворе и позволяет обеспечить непрерывность электронного и ионного потоков.
В-третьих, электролит также выполняет функцию защиты электродов от коррозии. При присутствии электролита, коррозия металлов происходит сниженными темпами, так как электролит обеспечивает реакции гальванической защиты. Он может реагировать с металлами, создавая металлический оксид, который затем служит промежуточным катодом и уменьшает скорость коррозии металла.
Таким образом, электролит в гальванической системе выполняет ряд важных функций, обеспечивая проводимость электронов и ионов, участвуя в окислительно-восстановительных реакциях и защищая металлы от коррозии.
Вопрос-ответ

Что такое электрохимическая коррозия металлов?
Электрохимическая коррозия металлов - это процесс разрушения металлической поверхности под воздействием окружающей среды и электрических токов.
Каким образом происходит электрохимическая коррозия металлов?
Электрохимическая коррозия металлов развивается в результате электрохимических реакций, где металлы выступают в качестве анодов и катодов. Металлическая поверхность анода окисляется, а поверхность катода восстанавливается.
Какие факторы влияют на скорость электрохимической коррозии?
Скорость электрохимической коррозии металлов зависит от таких факторов, как тип металла, состояние окружающей среды (влажность, температура, наличие агрессивных химических веществ), а также наличие кислорода и наличие проводника, который соединяет анод и катод.
Что такое гальванический элемент?
Гальванический элемент - это устройство, которое преобразует химическую энергию в электрическую энергию. Он состоит из двух полуреакций, проходящих на аноде (окисление) и катоде (восстановление), а также электролита, который позволяет перемещаться ионам в реакции.
Как работает гальванический элемент?
В гальваническом элементе, электрохимические реакции на аноде и катоде приводят к перемещению заряда через внешнюю цепь. Это создает потенциал разности между анодом и катодом, который можно использовать для питания электрических устройств.
