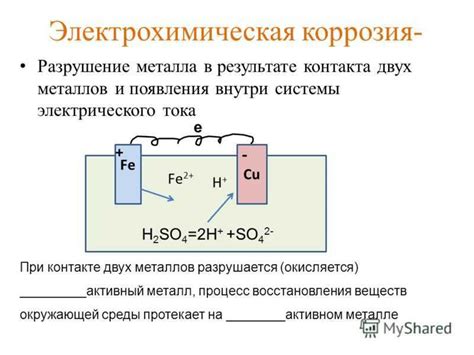
Электрохимическая коррозия – это процесс разрушения металлов под воздействием химических реакций, протекающих при наличии электрического потенциала. Один из распространенных примеров коррозии – взаимодействие металла с водным раствором соды. Коррозия в данном случае происходит за счет образования электрохимического элемента, который состоит из двух полуэлементов – анодного и катодного.
При взаимодействии металла с водным раствором соды на поверхности металла происходит окисление, а на обратной стороне – восстановление. Окисление соответствует полуэлементу анода, восстановление – полуэлементу катода. При этом происходит перенос электрических зарядов через электролит (раствор соды) со скоростью, зависящей от электрохимической активности металла и свойств электролита.
Перенос электрических зарядов приводит к ускоренной коррозии металла, так как восстановительные и окислительные процессы на поверхности металла происходят с большей интенсивностью. В результате коррозии металла на его поверхности образуется оксиды и гидроксиды металла, которые удаляются из зоны взаимодействия металла и раствора.
Подводя итог, электрохимическая коррозия при взаимодействии металла с водным раствором соды является результатом образования электрохимического элемента, состоящего из анодного и катодного полуэлементов. Перенос электрических зарядов приводит к более интенсивным окислительно-восстановительным реакциям, что приводит к ускоренной коррозии металла и образованию оксидов и гидроксидов на его поверхности.
Причины электрохимической коррозии
Электрохимическая коррозия – это процесс разрушения металла под воздействием воды и других химических веществ. Она возникает из-за сложного взаимодействия различных факторов, включая химическую среду, электрические потенциалы и микроструктуру материала.
Одной из основных причин электрохимической коррозии является наличие воды, которая действует как электролит и обеспечивает передачу электрического тока между различными участками поверхности металла. Вода содержит растворенные ионные вещества, которые могут вызывать различные химические реакции с металлом.
Реакции, происходящие при электрохимической коррозии, могут быть анодными или катодными. В процессе анодной реакции на поверхности металла происходит окисление, при котором металл переходит в ионы и выделяется электрический ток. В то же время, на катоде происходит восстановление ионообразованного металла.
Помимо влияния воды и ионных веществ, электрохимическая коррозия также зависит от электрических потенциалов различных участков поверхности металла. Если на поверхности металла присутствуют микроэлементы или дефекты структуры, то возникают гальванические пары, которые приводят к разрушению материала.
Таким образом, электрохимическая коррозия металла при взаимодействии с водным раствором соды вызвана совокупностью различных факторов, включая химическую среду, ионные реакции и электрические потенциалы. Понимание причин этого процесса позволяет разработать методы предотвращения и защиты металлических конструкций от коррозии.
Взаимодействие металла с водным раствором соды

Взаимодействие металла с водным раствором соды является электрохимическим процессом, в результате которого возникает коррозия. Сода, или гидроксид натрия, при растворении в воде ионизируется на соли, что приводит к изменению реакции между металлом и окружающей средой.
При взаимодействии металла с водным раствором соды происходит процесс анодного растворения металла, а каталитическая активность гидроксида натрия обеспечивает проявление электрохимической коррозии. Это значит, что металлическая поверхность подвергается окислительному воздействию, что приводит к образованию оксидов и ионов металла.
При взаимодействии алюминия с водным раствором соды образуется оксид алюминия (Al2O3) и гидрооксид натрия (NaOH), которые являются основными компонентами, способствующими дальнейшему разрушению и коррозии металла. Погружение водного раствора соды на длительный период времени усиливает электрохимическую коррозию, что приводит к деградации металлической поверхности.
Важно отметить, что взаимодействие металла с водным раствором соды может привести к серьезным последствиям, таким как потеря механических свойств металла, повреждение конструкции или даже полное разрушение. Поэтому необходимо принять меры предосторожности, минимизировать контакт металла с водными растворами соды и регулярно проверять состояние металлических поверхностей на наличие коррозии и проводить ремонтные работы при необходимости.
Роль электролита в процессе коррозии
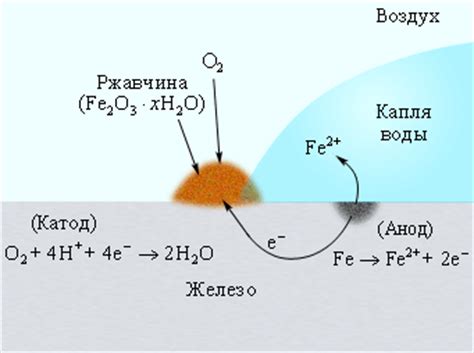
Электролит играет важную роль в процессе электрохимической коррозии металла при взаимодействии с водным раствором соды. Электролит – это вещество, способное проводить электрический ток, и он необходим для возникновения коррозионных реакций.
При наличии электролита происходит формирование электродных потенциалов на поверхности металла. Раствор соды содержит ионы гидроксида, NaOH, которые могут нейтрализовать оксиды и гидроксиды металла, присутствующие на его поверхности. Это приводит к вымыванию пассивного слоя с поверхности металла и обнажению активных мест.
Водный раствор соды является достаточно агрессивной средой, поскольку он обладает высокой электропроводностью и способен проводить электронный и ионный ток. При взаимодействии металла с раствором соды, ионы Na и OH проникают в структуру металла и способствуют электрохимическим реакциям коррозии.
На поверхности металла в присутствии электролита образуются различные активные и пассивные реакции. Активные реакции приводят к образованию оксидных пленок, которые могут быть нестабильными и распадаться, обнажая под ними новые активные участки металла. Пассивные реакции, напротив, способствуют образованию плотной и защитной пассивной оксидной пленки, которая может предотвращать коррозию.
Поведение металла в водном растворе соды
Взаимодействие металла с водным раствором соды может привести к электрохимической коррозии, которая является процессом разрушения металла под воздействием электрохимической реакции.
Сода, или гидроксид натрия, является щелочным раствором, который способен образовывать щелочные группы OH-, увеличивая концентрацию гидроксидных ионов в растворе. В присутствии воды гидроксидные ионы OH- могут реагировать с металлом, вызывая электрохимическую коррозию.
Коррозия металла в водном растворе соды может происходить как в результате непосредственного взаимодействия с поверхностью металла, так и через электролитическое воздействие, когда в растворе присутствуют и другие элементы, способствующие электрохимическим реакциям.
При взаимодействии металла с водным раствором соды могут образовываться различные продукты коррозии, такие как оксиды и гидроксиды металла, которые могут быть видимы на поверхности металла в виде помутнения, пятен или отложений.
Последствия электрохимической коррозии металла в водном растворе соды могут быть разрушительными, особенно если процесс продолжается в течение продолжительного времени. Коррозия может привести к потере прочности и интегритета металлических конструкций и поверхностей, что имеет серьезные последствия в различных отраслях, включая промышленность, автомобильное производство и строительство.
Химические реакции между металлом и содой
Электрохимическая коррозия металлов является одним из наиболее распространенных и разрушительных процессов. В частности, при взаимодействии металла с водным раствором соды (Na2CO3) происходят химические реакции, которые могут привести к коррозии и повреждению металлической поверхности.
Одной из основных причин коррозии металла в водном растворе соды является наличие кислорода и влаги, которые создают условия для электрохимических реакций. При этом, сода служит электролитом, обеспечивающим передачу электрического заряда между анодом и катодом.
На металлической поверхности электрохимической реакцией окисления металла образуется окисная пленка. Эта пленка может препятствовать дальнейшей коррозии, но в некоторых условиях она может быть разрушена или проникнуть внутрь металла, что приводит к его распаду.
Кроме того, при взаимодействии металла с содой могут происходить различные химические реакции, такие как образование гидроксидов металла и их дальнейшее растворение в водном растворе соды. Эти процессы могут ускорять процесс коррозии и повреждения металла.
Все эти химические реакции между металлом и содой могут привести к различным последствиям, включая потерю прочности металлической конструкции, разрушение поверхности металла, образование трещин и другие виды повреждений. Поэтому важно принять соответствующие меры для защиты металла от взаимодействия с содой и предотвращения коррозии.
Окислительно-восстановительные процессы в коррозии

Коррозия является процессом химического разрушения металла при взаимодействии с окружающей средой. Один из основных механизмов коррозии - окислительно-восстановительные процессы, которые происходят между металлом, окислителем и восстановителем.
Окислитель - это вещество, которое способно отбирать электроны у другого вещества и само при этом восстанавливаться. В водных растворах соды окислителями могут выступать кислород из воды или воздуха, а также другие вещества, находящиеся в растворе. Цветные и нецветные соединения металлов, такие как окиси или гидроксиды, обладают высоким окислительным потенциалом и способны участвовать в окислительно-восстановительных реакциях.
Восстановитель - это вещество, которое способно передавать электроны другим веществам и само при этом окисляться. Металл, подвергающийся процессу коррозии, выступает в этом случае в качестве восстановителя, отдавая свои электроны окислителю.
При взаимодействии металла с водным раствором соды происходит процесс окисления металла, т.е. его перехода в состояние ионов металла, что является реакцией окисления. В результате реакции восстановитель передает свои электроны окислителю, вследствие чего на металле образуется оксид. Это приводит к дальнейшему разрушению металла и образованию коррозионного продукта.
Окислительно-восстановительные процессы в коррозии являются ключевым фактором, определяющим скорость и масштабы разрушения металла под воздействием водного раствора соды. Понимание и контроль этих процессов важны для разработки методов защиты от коррозии и повышения долговечности металлических конструкций и изделий.
Последствия электрохимической коррозии
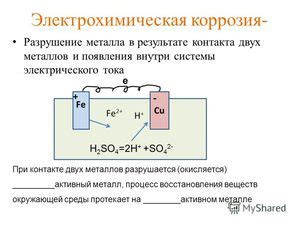
Электрохимическая коррозия при взаимодействии металла с водным раствором соды имеет серьезные последствия, которые могут привести к разрушению и повреждению материалов.
В первую очередь, коррозия приводит к образованию окислов и гидроксидов металла на его поверхности. Это приводит к изменению цвета и текстуры материала, делая его менее привлекательным и эстетичным.
Кроме того, электрохимическая коррозия может привести к потере механической прочности металлических изделий. Такое разрушение материала может быть особенно опасным, если коррозия происходит на элементах конструкций или механизмов, которые подвержены нагрузкам и силам. Это может привести к аварийным ситуациям и потере рабочих возможностей.
Более того, электрохимическая коррозия может способствовать образованию трещин и проводить к дальнейшему разрушению материалов. Это может быть особенно критично для легких конструкций, таких как самолеты или автомобили, где безопасность играет важную роль.
Следовательно, электрохимическая коррозия при взаимодействии металла с водным раствором соды является серьезной проблемой, которая требует внимания и мер по предотвращению. Коррозионная защита, регулярный мониторинг состояния материалов и использование антикоррозионных покрытий являются важными шагами в борьбе с этой проблемой.
Физические изменения в металле

Взаимодействие металла с водным раствором соды приводит к возникновению физических изменений в структуре материала. При электрохимической коррозии металла, ионы металла переходят в раствор и оставляют свободные электроны. Это приводит к образованию окисленных и покрытых солями слоев на поверхности металла.
Физические изменения металла включают в себя образование пятен, пузырьков, трещин и выступов на его поверхности. Эти изменения могут быть видны невооруженным глазом или требовать микроскопа для исследования. Кроме того, при коррозии металла могут происходить изменения в его механических свойствах, таких как твердость, прочность и пластичность.
Одной из особенностей физических изменений в металле при взаимодействии с водным раствором соды является образование коррозионных пятен. Эти пятна обычно имеют темно-коричневую или черную окраску, что свидетельствует о наличии окисленных слоев на поверхности металла. Они также могут быть неправильной формы и неоднородного размера, что указывает на неравномерность коррозионного процесса.
Продолжительное воздействие электрохимической коррозии на металл может привести к образованию трещин и выступов на его поверхности. Трещины могут быть мелкими и практически невидимыми, или же иметь значительные размеры и соединяться между собой, что ведет к разрушению металла. Выступы, с другой стороны, могут быть неровными и выделяться на поверхности металла, что также указывает на нарушение его интегритета.
Вопрос-ответ

Что такое электрохимическая коррозия?
Электрохимическая коррозия - это процесс разрушения металла, вызванный электрохимическими реакциями между металлом, окружающей средой и электрическим током. В результате коррозии металл постепенно разрушается и теряет свои свойства.
Почему металл корродирует при взаимодействии с водным раствором соды?
Вода может содержать различные растворенные вещества, в том числе и соду (Na2CO3). Взаимодействие металла с водным раствором соды приводит к образованию щелочной среды, которая может быть агрессивной для металла. Щелочная среда разрушает защитную пленку оксида на поверхности металла, что приводит к активации коррозионного процесса.
Какие могут быть последствия электрохимической коррозии металла при взаимодействии с водным раствором соды?
Последствия электрохимической коррозии при взаимодействии металла с водным раствором соды могут быть различными, в зависимости от металла и условий взаимодействия. Одним из типичных последствий является образование коррозионных накипей и отложений на поверхности металла, что может привести к его дальнейшей деструкции. Кроме того, коррозия может привести к уменьшению прочности и надежности конструкции, что может быть опасно в случае использования металла в технических системах.
