Электрохимическая коррозия является одной из наиболее распространенных и разрушительных форм коррозии металлов. Она возникает при взаимодействии металла с окружающей средой, что приводит к их деградации и повреждениям. Одним из основных факторов, способствующих электрохимической коррозии, является наличие электролита - среды, способной проводить электрический ток. Электролит может быть как жидким, например, вода или раствор, так и газообразным или твердым, обладающими влажностью и содержанием определенных химических веществ.
Коррозия металлов происходит в результате электрохимических реакций на поверхности металла. Один из главных процессов, приводящих к коррозии, - это окислительно-восстановительное взаимодействие металла с окружающей средой. В этом процессе металл выделяет электроны, образуя положительно заряженные ионы, которые растворяются в электролите. Одновременно с этим, протекает обратная реакция, где молекулы электролита или вещества взаимодействуют с электронами, вызывая разрушение металла. Таким образом, электрохимическая коррозия является реакцией электрохимии и химии, которая разрушает металлы и их конструкции с течением времени.
Существуют различные способы предотвращения электрохимической коррозии металлов. С одной стороны, можно использовать покрытия для защиты металла от воздействия окружающей среды. Такие покрытия могут быть нанесены на поверхность металла в виде пластины, материала или пленки, которые предотвращают контакт с окружающей средой. Второй способ предотвращения коррозии - использование комплексных соединений, которые образуют защитную пленку на поверхности металла и предотвращают его окисление. Такие соединения могут быть добавлены к электролиту или использоваться в качестве пропитки для металла.
Электрохимическая коррозия металлов

Электрохимическая коррозия – это процесс разрушения металлической поверхности под воздействием химических реакций, которые возникают вследствие взаимодействия металла с окружающей средой. Основным механизмом электрохимической коррозии является образование гальванических элементов, в которых разные участки металла выступают в роли анодов и катодов.
При электрохимической коррозии металл двигается в сторону анода, освобождая электроны и растворяясь в форме ионов. Этот процесс называется окислением. Катод же — место, где происходит поглощение электронов и протекание восстановительной реакции. В результате окислительно-восстановительных процессов металлическая поверхность корродирует и образуется оксиды, гидроксиды или соли металла.
Электрохимическая коррозия металлов является результатом сочетания электрохимических и химических процессов. Она может привести к значительному разрушению металла и его свойств, что часто приводит к снижению надежности и долговечности конструкций из металла. Поэтому очень важно предотвращать коррозию металлов и применять специальные методы защиты, такие как покрытия, антикоррозионные покрытия, активная и пассивная защита.
Причины электрохимической коррозии
Электрохимическая коррозия является одной из основных причин разрушения металлических конструкций. Она возникает в результате взаимодействия металла с окружающей средой под воздействием электрических или химических процессов. Прочность и долговечность материалов страдают от коррозии, что может привести к серьезным последствиям для сооружений и оборудования.
В основе электрохимической коррозии лежит процесс окисления металла под действием кислорода или других окислителей, которые могут содержаться в воде, влажности воздуха или химических реагентах. Коррозия активно протекает в присутствии электролита, такого как вода или соли. Вода обладает высокой способностью проводить электрический ток, поэтому она может усиливать коррозию металла.
Наличие местных активных участков в металле, таких как дефекты, микротрещины или примеси, является одной из главных причин электрохимической коррозии. На этих участках происходит активное образование оксидов металла, что приводит к разрушению его структуры. Дифференциальная аэрация около этих участков вносит вклад в разделение процессов окисления и восстановления на металле, что усиливает его разрушение.
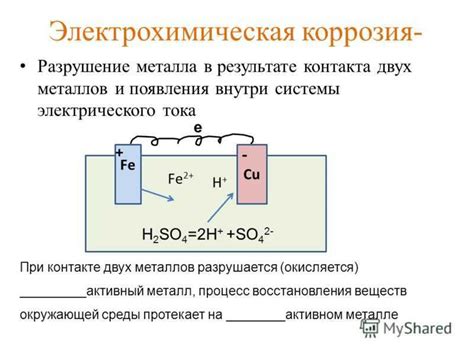
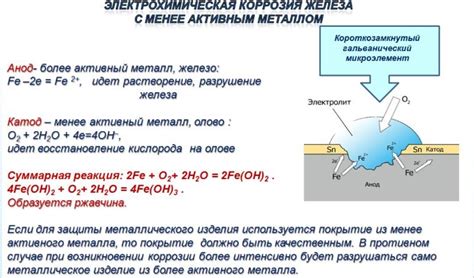
Одной из форм электрохимической коррозии является гальваническая коррозия, которая возникает при контакте двух различных металлов в присутствии электролита. На более активном металле, называемом анодом, происходит окисление, а на менее активном металле, называемом катодом, происходит восстановление. Этот электрохимический процесс приводит к разрушению анода.
Для предотвращения электрохимической коррозии используются различные методы и техники. Одним из них является защитное покрытие, которое предотвращает контакт металла с окружающей средой. Другой метод - использование анодной или катодной защиты, при которой вводятся специальные аноды или катоды в систему, создающие меньшее активное электродное потенциал. Это позволяет предотвращать процессы коррозии.
Формулы для объяснения электрохимической коррозии
Электрохимическая коррозия металлов может быть объяснена с помощью нескольких формул, которые описывают основные процессы, происходящие во время коррозии.
Одна из основных формул, используемых для объяснения коррозии, - это уравнение Гиббса-Гельмгольца, которое показывает зависимость электрохимического потенциала металла от концентрации растворенных ионов. Формула записывается следующим образом:
ΔG = -nFE
где ΔG - изменение свободной энергии, n - количество электронов, участвующих в реакции, F - постоянная Фарадея, E - электрохимический потенциал.
Еще одна важная формула, связанная с коррозией металлов, - это уравнение Нернста, которое описывает зависимость электродного потенциала от концентрации ионов в растворе. Уравнение выглядит следующим образом:
E = E0 - (RT/nF) ln(Q)
где E - электродный потенциал, E0 - стандартный электродный потенциал, R - газовая постоянная, T - температура, n - количество электронов, участвующих в реакции, F - постоянная Фарадея, Q - отношение концентраций веществ, участвующих в реакции.
Также для объяснения электрохимической коррозии металлов могут использоваться формулы, описывающие образование окислительно-восстановительных пар и реакции на поверхности металла. Одной из таких формул является уравнение Оксонио-редукции:
Оксидант + Вещество → Вещество + Восстановитель
где Оксидант - вещество, принимающее электроны и окисляющееся, Вещество - вещество, участвующее в реакции, Восстановитель - вещество, отдающее электроны и восстанавливающееся.
Эти формулы позволяют лучше понять основные принципы электрохимической коррозии металлов и разработать способы ее предотвращения.
Влияние окружающей среды на коррозию металлов

Окружающая среда является одним из основных факторов, влияющих на процесс коррозии металлов. Взаимодействие металла с окружающей средой может вызывать различные химические реакции, приводящие к разрушению металлической структуры.
Наличие воды в окружающей среде существенно усиливает процесс коррозии. Вода является электролитом, способным проводить электрический ток, и создает условия для реакции окисления и восстановления металла. Концентрация кислорода и других активных химических веществ в воде также оказывает влияние на протекание коррозионных процессов.
Также влияние на коррозию металлов оказывает наличие агрессивных химических веществ в окружающей среде. Кислотные пары, соли, хлориды и другие вещества способны активизировать коррозионные процессы, агрессивно взаимодействуя с металлической поверхностью.
Температура окружающей среды также является важным фактором влияния на коррозию металлов. При повышенной температуре процесс коррозии может ускоряться, так как химические реакции протекают быстрее при повышении температуры.
Чтобы предотвратить коррозию металлов в различных условиях, необходимо применять различные способы защиты. Это может быть использование покрытий, антикоррозионных составов, использование анодной защиты или электрохимической полировки. Также возможно применение специальных сплавов и металлов, устойчивых к коррозии в конкретной среде.
Катоды и аноды в электрохимической коррозии

Электрохимическая коррозия металлов происходит при взаимодействии среды и металла, которое основано на электрохимических процессах. В этих процессах металл, действуя как анод, переходит в ионное состояние, выделяя электроны, которые посредством проводника переносятся к катоду. Катоды, находящиеся в контакте с металлом, принимают электроны, одновременно происходит их диссоциация, что позволяет восстанавливать металл в ионное состояние.
Аноды в электрохимической коррозии представлены поверхностью металла, на которой происходит окисление, атмосферный кислород или другие окислительные вещества взаимодействуют с металлом, вызывая его разрушение. Электрохимический процесс, протекающий на аноде, является основной причиной коррозии металлов.
Катоды в электрохимической коррозии выполняют роль электродов, на которые переносятся электроны от анодов. Катоды обладают большей отрицательной электрической потенциальной энергией по сравнению с анодами, поэтому они являются местами притяжения электронов и окислительных веществ. На поверхности катода металл восстанавливается, происходит накапливание осадков и образуется защитный слой, который замедляет скорость коррозии.
Важно учитывать, что катоды и аноды в электрохимической коррозии образуют пары разных металлов, что может приводить к образованию гальванической пары. Гальваническая пара создает условия для активной коррозии, так как наличие двух разных металлов и различных электрохимических потенциалов приводит к образованию электродной пары, где один металл выступает в роли анода, а другой – в роли катода. Это приводит к ускорению электрохимической коррозии металла.
Электролиты и их роль в процессе коррозии

Электролиты играют ключевую роль в процессе электрохимической коррозии металлов. Они являются веществами, способными проводить электрический ток, и обычно представляют собой растворы солей или кислот. Взаимодействие металла, воздействующего среды и электролитов приводит к возникновению коррозии.
В процессе коррозии, металл выступает в роли анода, а окружающая среда с электролитами – в роли катода. Между ними возникает гальваническая ячейка, где происходит электрохимический процесс коррозии. В данной ячейке электролиты обеспечивают перемещение ионов между металлом и окружающей средой, что проявляется в потенциале и скорости коррозии.
Различные типы электролитов могут вызывать разные типы коррозии. Например, кислые электролиты способствуют коррозии алюминия и цинка, а щелочные электролиты способствуют коррозии алюминия и магния. Хлориды и сульфаты являются наиболее агрессивными электролитами, способствующими коррозии металлов.
Для предотвращения коррозии, необходимо контролировать концентрацию и состав электролитов, а также создавать защитные покрытия для металлов. Отбор и использование подходящих ингибиторов коррозии, которые препятствуют электрохимическим реакциям между металлом и электролитом, также являются важными методами предотвращения коррозии.
Методы предотвращения электрохимической коррозии

Одним из способов предотвращения электрохимической коррозии является применение непроводящих покрытий на поверхности металла. Эти покрытия, такие как краски, эмали или пластиковые пленки, создают барьер между металлом и агрессивной средой, предотвращая проникновение влаги и кислорода на поверхность металла.
Другим методом предотвращения коррозии является применение антикоррозионных покрытий на поверхности металла. Данные покрытия создают защитный слой, который замедляет процесс коррозии и подавляет химические реакции на поверхности металла. Антикоррозионные покрытия могут быть нанесены методом покраски, гальванического осаждения, термической обработки и другими способами.
Также возможно использование коррозионно-стойких сплавов и металлов для изготовления конструкций. Эти материалы обладают повышенной устойчивостью к электрохимической коррозии и способны сохранять свои свойства в агрессивных средах.
Кроме того, можно использовать методы катодной и анодной защиты. Катодная защита основана на создании электрического поля, которое сдвигает потенциал металла в сторону катода и предотвращает его коррозию. Анодная защита, напротив, основана на создании поля, которое сдвигает потенциал металла в сторону анода, что ускоряет коррозию окружающих его материалов и предотвращает поражение самого металла.
Наконец, регулярное обслуживание и проведение периодической инспекции оборудования и конструкций также помогает предотвратить электрохимическую коррозию. Раннее выявление признаков коррозии позволяет принять меры по ее предотвращению и устранению до появления существенных повреждений.
Покрытия и антикоррозионные материалы

Покрытия и антикоррозионные материалы являются важным средством предотвращения электрохимической коррозии металлов. Они создают защитный слой, который предотвращает взаимодействие металла с окружающей средой и повышает его стойкость к коррозии.
Одним из наиболее эффективных покрытий является гальваническое покрытие. Оно получается путем погружения металлического изделия в электролит, содержащий соединения выбранного покрытия. За счет электролиза на поверхности металла образуется покрытие с желаемыми свойствами, которое обеспечивает защиту от коррозии.
Другим способом защиты от коррозии является использование антикоррозионных материалов, которые наносятся на поверхность металла. Они могут быть представлены в виде красок, лаков, пленок или покрытий из специальных соединений. Антикоррозионные материалы обладают высокой адгезией к металлу и хорошей устойчивостью к воздействию окружающей среды.
Важным элементом антикоррозионных покрытий является применение ингибиторов коррозии. Их задача заключается в уменьшении активности коррозионных процессов на поверхности металла. Ингибиторы могут быть добавлены в состав антикоррозионных материалов или использоваться отдельно, например, в виде пропиток или специальных растворов для обработки металлических поверхностей.
Кроме того, существует такой вид защиты от коррозии, как использование композитных покрытий. Композитное покрытие состоит из нескольких слоев различных материалов. Это позволяет достичь запаса прочности и долговечности, а также обеспечить защиту металла от воздействия окружающей среды.
В целом, использование покрытий и антикоррозионных материалов играет важную роль в борьбе с электрохимической коррозией металлов. Они повышают стойкость металла к коррозии и увеличивают его срок службы, что является важным фактором для повышения надежности и качества различных металлических изделий и конструкций.
Вопрос-ответ

Что такое электрохимическая коррозия металлов?
Электрохимическая коррозия металлов - это процесс разрушения металла, вызванный электрохимическими реакциями, происходящими между металлом и окружающей средой. В результате этих реакций металл превращается в оксиды, гидроксиды или соли, что приводит к потере прочности и долговечности материала.
Какие причины вызывают электрохимическую коррозию металлов?
Электрохимическая коррозия металлов вызывается комбинацией нескольких факторов. Основные причины включают в себя наличие влаги, наличие кислорода в окружающей среде, присутствие агрессивных химических веществ, различия в потенциалах электродов и наличие электролита, обеспечивающего проводимость электрического тока между металлом и окружающей средой.
