Оксиды металлов - это неорганические соединения, состоящие из металла и кислорода. Имеющие широкий спектр применения в различных отраслях промышленности. Эти соединения обладают различными свойствами, включая электропроводность, которая является одной из важных характеристик оксидов металлов.
Электропроводность оксидов металлов в таблице различается в зависимости от ряда факторов, таких как структура соединения, тип металла, степень окисления и прочие. Некоторые оксиды металлов обладают высокой электропроводностью и могут использоваться в качестве проводников электричества. Другие оксиды металлов, напротив, обладают низкой электропроводностью и не могут использоваться в данном качестве.
На основе таблицы электропроводности оксидов металлов можно выделить несколько групп. Первая группа включает оксиды металлов, которые сами по себе являются проводниками электричества. Это, например, оксиды металлов группы переходных металлов, таких как оксиды железа, меди, никеля и т.д. Вторая группа состоит из оксидов металлов, которые обладают полупроводниковыми свойствами. Например, оксиды кремния и титана. Третья группа - это оксиды металлов, которые являются диэлектриками и не проводят электричество.
Исследование электропроводности оксидов металлов в таблице позволяет получить информацию о их физических свойствах и потенциальных областях применения. Это важная информация для разработки новых материалов и технологий в различных отраслях науки и промышленности.
Значение электропроводности в оксидах металлов
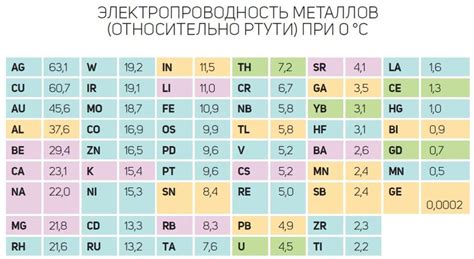
Оксиды металлов являются соединениями, в которых атомы металла связаны с атомами кислорода. Эти соединения обладают различной степенью электропроводности, что определяется структурой и свойствами их кристаллической решетки.
Наиболее известным оксидом металла является оксид алюминия (Al2O3), который обладает высокой электропроводностью благодаря наличию в его структуре дефектов, таких как вакансии и интерстициальные атомы. Эти дефекты позволяют свободно перемещаться электронам и обеспечивают проводимость вещества.
Однако, большинство оксидов металлов обладают низкой электропроводностью, так как их кристаллическая структура не содержит дефектов. В этом случае электропроводность осуществляется за счет ионной проводимости, когда ионы металла перемещаются вдоль решетки оксида. Под действием электрического поля, ионы металла смещаются в одну сторону, а ионы кислорода в другую, что обеспечивает проводимость вещества.
Некоторые оксиды металлов, например оксид цинка (ZnO) и оксид кадмия (CdO), обладают полупроводниковыми свойствами и могут применяться в электронике и фотоэлектрике. Эти соединения имеют широкую запрещенную зону, что позволяет контролировать их электропроводность путем добавления примесей или изменением условий их синтеза.
В заключение, электропроводность оксидов металлов зависит от свойств их кристаллической структуры. Они могут обладать высокой электропроводностью за счет дефектов, ионной проводимости или полупроводниковых свойств, и это определяет их возможные применения в различных сферах науки и техники.
Оксиды металлов в таблице Менделеева
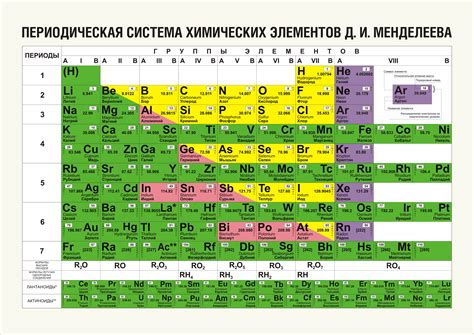
Оксиды металлов - это химические соединения, образованные металлом и кислородом. Они широко представлены в таблице Менделеева и играют важную роль в различных областях науки и промышленности.
В таблице Менделеева оксиды металлов обычно представлены в виде химических символов, указывающих на соответствующий металл и его оксидационное состояние. Например, FeO обозначает оксид железа, CuO - оксид меди и Al2O3 - оксид алюминия.
Оксиды металлов могут иметь различные физические и химические свойства. Некоторые из них являются электропроводными и используются в производстве электроники и электротехнике. Например, оксид железа Fe2O3, известный как ржавчина или гематит, используется в производстве магнитных материалов и керамики.
Другие оксиды металлов могут быть полупроводниками или непроводниками. Например, оксид кремния SiO2 является основным материалом в производстве полупроводниковых приборов, таких как транзисторы и микросхемы. Оксиды металлов также могут быть использованы в качестве катализаторов, пигментов и много других веществ.
Таким образом, оксиды металлов в таблице Менделеева представляют собой разнообразные химические соединения с различными свойствами и применениями. Их изучение и использование играют важную роль в развитии современных технологий и научных открытий.
Расположение оксидов металлов в таблице
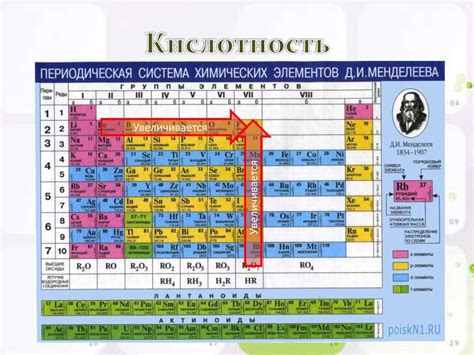
Оксиды металлов представляют собой химические соединения, состоящие из металла и кислорода. Они широко используются в различных отраслях промышленности, включая производство керамики, стекла и металлургию.
Расположение оксидов металлов в таблице Менделеева зависит от их валентности и электрохимических свойств. Обычно оксиды металлов располагаются в верхней части таблицы их расходятся влево и вправо.
Оксиды металлов, расположенные в верхней части таблицы, обычно обладают большей электропроводностью. Например, оксиды щелочных металлов (натрий, калий), расположенные в первой группе таблицы, обладают высокой электропроводностью и являются хорошими проводниками электричества.
Однако, с увеличением атомного номера и валентности, электропроводность оксидов металлов уменьшается. Оксиды переходных металлов, например железа и меди, обычно обладают менее высокой электропроводностью, чем оксиды щелочных металлов.
При этом, некоторые оксиды металлов могут обладать как полупроводниковыми свойствами - то есть иметь средние значения электропроводности. Такие оксиды располагаются в различных частях таблицы и могут использоваться в электронике и солнечных батареях.
- Оксиды металлов в таблице располагаются в верхней части и по сторонам таблицы.
- Оксиды щелочных металлов имеют высокую электропроводность.
- Оксиды переходных металлов имеют более низкую электропроводность.
- Некоторые оксиды металлов обладают свойствами полупроводников.
Степень окисления металлов в оксидах
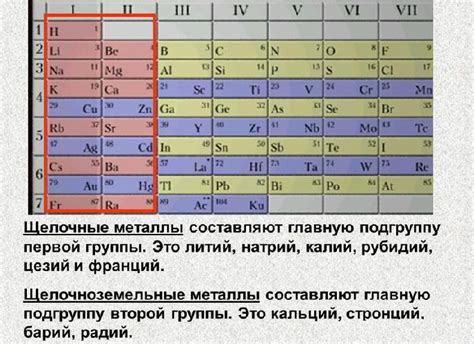
Оксиды металлов являются химическими соединениями, состоящими из металлического элемента и кислорода. При образовании оксидов металлы переходят в более низкую степень окисления. Степень окисления металла в оксиде может быть определена с учетом электроотрицательности элементов.
Степень окисления металлов в оксидах имеет важное значение для определения их электропроводности. Металлы, имеющие более низкую степень окисления, обладают лучшей электропроводностью. Это объясняется тем, что металлы в более низкой степени окисления имеют свободные электроны, которые могут свободно передвигаться по проводнику.
Например, металлы в оксидах типа MnO, FeO и Cu2O имеют степень окисления +2. Эти металлы обычно являются хорошими проводниками электричества. Степень окисления +2 означает, что металл потерял два электрона и стал положительно заряженным.
С другой стороны, металлы в оксидах типа Mn2O7, Fe2O3 и CuO имеют более высокую степень окисления. Такие оксиды металлов обычно являются плохими проводниками электричества. Степень окисления +7 для Mn2O7 означает, что металл потерял семь электронов и стал еще более положительно заряженным.
Таким образом, степень окисления металлов в оксидах является важным фактором, определяющим их электропроводность. Металлы в более низкой степени окисления обычно обладают лучшей электропроводностью, благодаря наличию свободных электронов.
Влияние степени окисления на электропроводность

Электропроводность - это способность вещества проводить электрический ток. Степень окисления металла в оксидах существенно влияет на его электропроводность. При рассмотрении таблицы оксидов металлов можно заметить, что степень окисления влияет на различные свойства оксидов, включая электропроводность.
Степень окисления представляет собой число, которое указывает, сколько электронов атом или ион металла потерял при образовании соответствующего оксида. Этот показатель непосредственно связан с количеством электронов, доступных для передачи тока.
Основной механизм электропроводности в оксидах металлов - это передача электронов. Чем больше электронов доступно для передачи, тем выше будет электропроводность оксида. В случае, если металл имеет более высокую степень окисления, большее количество электронов будет перенесено на кислород, что снизит электропроводность.
Например, оксид магния (MgO), в котором магний имеет степень окисления +2, является диэлектриком, так как в нем отсутствуют свободные электроны для проведения тока. Однако, оксид меди (CuO), в котором медь имеет степень окисления +2, проявляет полупроводниковые свойства из-за наличия свободных электронов, которые могут проводить электрический ток.
Таким образом, степень окисления металла в оксидах металлов оказывает значительное влияние на электропроводность. Чем больше электронов доступно для передачи, тем выше будет электропроводность оксида. Понимание этой зависимости помогает в объяснении свойств различных оксидов и может быть использовано для разработки новых материалов с определенными электропроводными свойствами.
Типы оксидов металлов
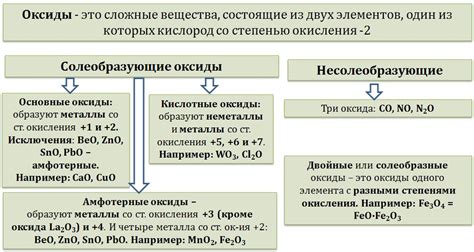
Оксиды металлов — это химические соединения, состоящие из металла и кислорода. В зависимости от валентности металла и соотношения его атомов с атомами кислорода, оксиды металлов делятся на различные типы.
Первый тип оксидов металлов - бинарные оксиды. Они образуются из одного металла и одного кислорода. Примерами таких оксидов являются оксиды натрия (Na2O), калия (K2O) и кальция (CaO). Бинарные оксиды часто обладают сильными щелочными свойствами и способны реагировать с кислотами.
Второй тип оксидов металлов - кислотные оксиды. Они содержат металл с менее выраженной валентностью и формируют кислородные кислоты. Например, оксиды серы (SO2) и азота (NO2) являются кислотными оксидами. Они обладают кислыми свойствами и могут реагировать с основаниями для образования солей.
Третий тип оксидов металлов - амфотерные оксиды. Они способны образовывать и с кислотами, и с основаниями, в зависимости от условий реакции. Некоторые примеры амфотерных оксидов - оксиды алюминия (Al2O3) и цинка (ZnO). Они могут реагировать как с кислотами, так и с основаниями для образования солей.
В таблице электропроводности оксидов металлов представлены данные о том, являются ли оксиды металлов электропроводными или неэлектропроводными. Некоторые оксиды металлов обладают высокой электропроводностью, а некоторые - низкой или даже нулевой. Это связано с их структурой и свойствами, которые определяют способность вещества проводить электрический ток.
Кислые оксиды
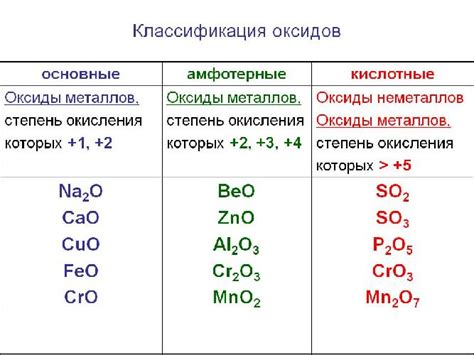
Кислые оксиды - это класс оксидов металлов, которые образуются при взаимодействии металлов с кислородом. Они характеризуются высоким электропроводящим свойством и обычно имеют кислую природу.
Кислые оксиды вступают в реакцию с водой, образуя кислоты. Это свойство обусловлено тем, что оксиды металлов в данном классе содержат высокоположительные ионы металлов, которые легко отдают протоны.
Кислые оксиды широко используются в промышленности. Они являются важными сырьем для производства различных химических соединений, таких как кислоты, соли и другие оксиды. Некоторые кислые оксиды также используются в качестве катализаторов реакций.
Примерами кислых оксидов являются оксиды серы (SO2), азота (NO2) и углерода (CO2). Эти оксиды главным образом образуются в результате процессов сжигания топлива. Они являются причинами возникновения кислотных осадков и загрязнения атмосферы, и поэтому считаются вредными для окружающей среды.
Физические и химические свойства оксидов металлов

Физические свойства:
- Оксиды металлов обычно являются твёрдыми веществами с высокими температурами плавления и кипения.
- В зависимости от структуры оксидов металлов могут быть кристаллическими или аморфными.
- Многие оксиды металлов обладают химической инертностью и сопротивляются окислению и коррозии.
Химические свойства:
- Оксиды металлов могут реагировать с водой, кислотами или щелочами, образуя различные соединения.
- Некоторые оксиды металлов обладают амфотерными свойствами, то есть могут реагировать как с кислотами, так и с щелочами.
- Некоторые оксиды металлов обладают полупроводниковыми свойствами и используются в электронике и солнечных батареях.
- Оксиды металлов могут образовывать соли при реакции с кислотами.
Роль оксидов металлов в природе и промышленности:
- Некоторые оксиды металлов являются природными ресурсами и используются в производстве металлов.
- Многие оксиды металлов применяются в качестве катализаторов в химической промышленности.
- Оксиды металлов могут использоваться в качестве пигментов и красителей в промышленности.
Температурная зависимость электропроводности
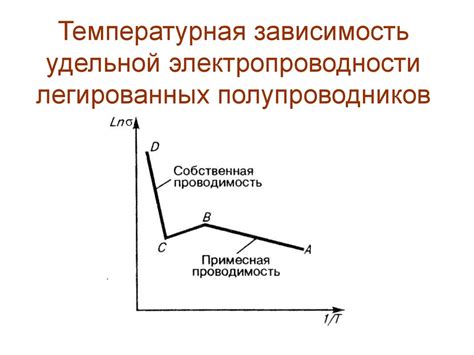
Электропроводность оксидов металлов сильно зависит от температуры. Температурная зависимость может быть исследована с помощью специальных экспериментов.
При низких температурах обычно наблюдается низкая электропроводность оксидов металлов. Это связано с тем, что при низких температурах электроны, несущие электрический заряд, имеют низкую энергию и слабо покидают атомы металла.
С увеличением температуры, электропроводность оксидов металлов увеличивается. Это происходит из-за того, что с ростом температуры электроны приобретают большую энергию и могут легче покидать атомы металла.
Однако, при очень высоких температурах электропроводность оксидов металлов может снижаться. Это связано с тем, что при высоких температурах атомы металла могут начать сильнее колебаться и размывать кристаллическую решетку, что приводит к ухудшению проводимости.
Температурная зависимость электропроводности оксидов металлов может быть представлена в виде графика, где по оси абсцисс отложена температура, а по оси ординат – электропроводность. Последовательное изменение электропроводности оксидов металлов в зависимости от температуры позволяет определить время, в течение которого материал может быть использован в различных условиях.
Вопрос-ответ

Какие оксиды металлов являются проводниками?
Электропроводность оксидов металлов зависит от ряда факторов, включая тип металла, степень окисления и его структуру. Оксиды металлов, которые часто проявляют проводящие свойства, включают оксиды щелочных металлов, таких как оксид натрия и оксид калия, а также некоторые переходные металлы, например, оксиды железа и меди.
Почему оксиды металлов могут быть электропроводными?
Оксиды металлов могут быть электропроводными из-за наличия свободных электронов в их структуре. Металлы обладают электронами, которые могут легко перемещаться по их структуре, и эти электроны играют роль в проводимости. Когда металл доходит до окисления, свободные электроны могут остаться в структуре оксида, делая его электропроводным.
Какие металлы образуют наиболее проводящие оксиды?
Некоторые металлы образуют оксиды, которые обладают особенно высокой электропроводностью. К таким металлам относятся щелочные металлы (например, натрий, калий), щелочноземельные металлы (например, магний, кальций), а также некоторые переходные металлы (например, железо, медь, никель). Эти металлы имеют свойство образовывать оксиды с высоким содержанием свободных электронов, что делает их электропроводными.
Как структура оксида металла влияет на его электропроводность?
Структура оксида металла может существенно влиять на его электропроводность. Например, металлический тип структуры, в которой атомы металла формируют плотную решетку, обычно способствует электропроводности. Это обусловлено свободными электронами, которые могут перемещаться по решетке и создавать электрический ток.
