Электропроводность - это способность вещества пропускать электрический ток. Металлы и электролиты являются двумя основными типами веществ, которые обладают этим свойством, но их особенности и механизмы действия отличаются.
Металлы - это материалы, в которых электроны внешней оболочки атомов легко движутся и свободно перемещаются под влиянием электрического поля. Электроны в металлах образуют так называемое "электронное море", что делает эти материалы отличными проводниками электричества. Под воздействием внешнего электрического поля, электроны начинают двигаться в определенном направлении, что вызывает электрический ток.
В отличие от металлов, электролиты - это вещества, в которых электрический ток передается не электронами, а ионами. Ионы - это атомы или молекулы, которые потеряли или приобрели один или несколько электронов, став положительно или отрицательно заряженными. В электролитах ионы движутся под влиянием электрического поля, образуя ионные потоки и передавая электрический ток. Примерами электролитов могут служить водные растворы солей, кислоты или щелочи.
Таким образом, основное отличие между электропроводностью металлов и электролитов заключается в том, как передается электрический ток - электронами или ионами. Металлы обладают высокой электропроводностью благодаря подвижности свободных электронов, в то время как электролиты передают электрический ток через ионные потоки. Ознакомление с этими особенностями поможет понять принципы действия электропроводящих материалов и применять их в различных областях науки и техники.
Роль электропроводности в физике

Электропроводность играет важную роль в физике и является одним из основных понятий в области электричества и электромагнетизма. Это свойство вещества позволяет проводить электрический ток и является основой для функционирования электрических цепей, проводников и устройств.
Уровень электропроводности вещества зависит от его структуры и химического состава. Металлы, такие как медь или алюминий, обладают высокой электропроводностью благодаря свободным электронам, которые могут свободно двигаться внутри металлической решетки. Это позволяет проводить электрический ток без значительного сопротивления.
В отличие от металлов, электролиты, такие как растворы солей или кислот, обладают низкой электропроводностью в твердом состоянии, но становятся проводящими при растворении или плавлении. Это происходит за счет образования ионов, которые могут перемещаться в растворе и создавать электрический ток.
Роль электропроводности в физике распространяется на множество явлений и приложений. Она позволяет нам использовать электропроводящие материалы для создания электрических цепей, проводников и устройств, таких как провода, лампы, моторы и транзисторы. Благодаря пониманию принципов электропроводности, мы можем разрабатывать эффективные и энергосберегающие технологии, а также изучать электрические явления в природе и воздействовать на них.
Понятие электропроводности
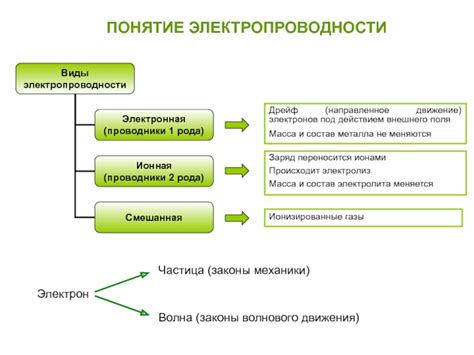
Электропроводность - это способность вещества или материала проводить электрический ток. Она является одной из важных характеристик металлов и электролитов, которая определяется их структурой и химическими свойствами. В металлах электропроводность обусловлена наличием свободных заряженных частиц, таких как электроны, которые могут свободно перемещаться по материалу. В электролитах электропроводность обусловлена наличием ионов, которые диссоциируют в растворе и способны проводить электрический заряд.
Электропроводность металлов является высокой благодаря особенностям их кристаллической решетки и наличию свободных электронов. Данный механизм проводимости называется электронным типом проводимости. В металлах происходит движение электронов от положительно заряженной области к отрицательно заряженной, образуя электрический ток. При этом электроны могут свободно перемещаться внутри материала без значительного сопротивления, что и обусловливает высокую электропроводность металлов.
В электролитах электропроводность связана с наличием свободных ионов, которые образуются в процессе диссоциации молекул в растворе. Этот тип проводимости называется ионным. Ионы положительно и отрицательно заряжены и способны перемещаться в рамках раствора, создавая электрический ток при наличии разности потенциалов. В электролитах электропроводность зависит от концентрации ионов, их подвижности и внешней температуры. Электропроводность электролитов может быть изменена путем добавления различных веществ, которые либо увеличивают, либо уменьшают их проводимость.
Физические свойства электропроводников

Электропроводность - это способность вещества проводить электрический ток. Физические свойства электропроводников определяют их способность пропускать электрический ток.
Одной из основных характеристик электропроводников является их проводимость, которая зависит от концентрации свободных электронов. Чем больше свободных электронов имеется в материале, тем лучше он проводит ток. Атомы в металлах организованы в кристаллическую решетку, где некоторые из электронов находятся в состоянии свободных.
Металлы являются отличными электропроводниками благодаря наличию свободных электронов в облаке электронов кристаллической решетки. Электроны в металлах могут свободно передвигаться под воздействием электрического поля, образуя ток. Это позволяет металлам передавать электрическую энергию при проведении электрического тока.
Электролиты, в отличие от металлов, не содержат свободных электронов. В электролитах электрический ток передается за счет движения ионов. Ионы электролита могут двигаться под воздействием электрического поля, перемещаясь к положительному или отрицательному электроду.
Таким образом, основными различиями между электропроводниками (металлами) и электролитами являются наличие свободных электронов и ионов, а также механизм передачи электрического тока. В металлах электрический ток передается за счет движения свободных электронов, а в электролитах - за счет движения ионов.
Электропроводность металлов

Металлы обладают особым типом электропроводности, который отличается от электропроводности электролитов. Они характеризуются способностью свободно перемещать заряженные частицы - электроны.
Электропроводность металлов основана на наличии в их структуре так называемой "мореэлектронов", то есть электронов, которые свободно перемещаются по кристаллической решетке металла. Это объясняет высокую электропроводность металлов и их способность проводить электрический ток без существенного сопротивления.
В металлах электропроводность обусловлена наличием свободных электронов, которые отвечают за перенос заряда. Они образуют электронное облако или "море", которое свободно перемещается под действием внешнего электрического поля. Большую роль в электропроводности металлов играют также эффекты кинетического и термического возбуждения электронов.
Электропроводность металлов зависит от многих факторов, включая температуру, концентрацию свободных электронов, типы примесей и др. В некоторых случаях особые свойства металлов могут приводить к ухудшению их электрической проводимости, например, в результате образования оксидной пленки или образования дополнительных электронных состояний в зоне проводимости.
Свободные электроны
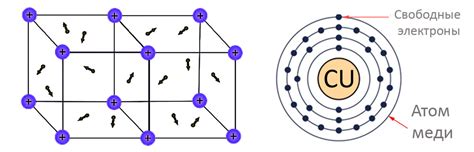
Свободные электроны являются ключевым понятием в объяснении электропроводности металлов. Электроны в металле не привязаны к отдельным атомам, а могут свободно перемещаться по всей структуре. Они обладают отрицательным зарядом и негативно откликаются на внешнее электрическое поле, создавая ток.
Проводимость металлов обусловлена наличием большого количества свободных электронов. Эти электроны формируют так называемый «электронный газ», заполняющий металлическую решетку. Благодаря свободному перемещению, электроны могут передавать энергию один другому и двигаться в направлении сильного электрического поля.
Существующий в металлообласти внешний электрический потенциал способствует перемещению свободных электронов в определенном направлении, создавая электрический ток. Под воздействием внешнего электрического поля, свободные электроны набирают определенную скорость и начинают сталкиваться с другими электронами и ионами, определяя таким образом электропроводность.
Значительной особенностью свободных электронов является их низкая масса и высокая подвижность, что позволяет им достаточно легко передвигаться по металлической структуре. Более того, свободные электроны обладают высокой энергией, что способствует эффективному передаче заряда и хорошей электропроводности металлов в обычных условиях.
Сильная связь между атомами
Металлы характеризуются высокой электропроводностью благодаря сильной связи между атомами. В металлах электроны находятся в общей зоне проводимости, и электрический ток передается свободными электронами. Связь между атомами в металлах осуществляется за счет металлической связи.
Металлическая связь предполагает наличие двух типов электронных облаков: внешней и внутренней. Внешнее электронное облако содержит свободные электроны, которые с легкостью могут перемещаться по металлу и обеспечивать электропроводность. Внутреннее электронное облако является результатом сильных связей между атомами и служит для поддержания структуры металла.
С другой стороны, электролиты обладают другим механизмом электропроводности. В электролитах ток передается не свободными электронами, а заряженными ионами. Ионы электролита могут двигаться под воздействием электрического поля и переносят с собой электрический заряд. Это дает возможность электролитам проводить электрический ток.
Таким образом, металлы и электролиты различаются основным механизмом электропроводности: в металлах это свободные электроны, в электролитах - ионы. Исходя из данных различий, можно сделать вывод, что металлы обладают гораздо более высокой электропроводностью по сравнению с электролитами.
Электропроводность электролитов
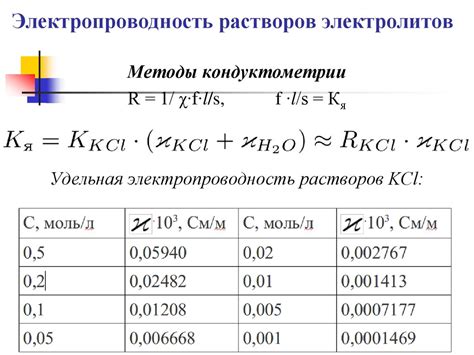
Электролиты - вещества, способные проводить электрический ток в расплавленном или растворенном состоянии. Их электропроводность основана на наличии свободно движущихся ионов в растворе или расплаве. Они обладают либо положительным, либо отрицательным электрическим зарядом и перемещаются под действием электрического поля.
Принцип действия электропроводности электролитов заключается в ионном переносе. Когда электролит растворяется в воде или расплавляется, его молекулы разделяются на положительно и отрицательно заряженные ионы. Заряженные частицы могут свободно перемещаться в растворе или расплаве, что позволяет электрическому току протекать.
Ионная проводимость электролитов зависит от различных факторов, включая концентрацию ионов, температуру, вязкость раствора и др. Также электропроводность электролитов может быть увеличена путем добавления определенных веществ, называемых электролитическими добавками, которые увеличивают концентрацию ионов в растворе.
Электропроводность электролитов имеет широкий спектр практических применений. Она играет важную роль в области химии, электролиза, аккумуляторных технологий, электрохимического анализа и т.д. Кроме того, электролиты используются в различных электрохимических процессах, таких как гальваническое покрытие металлов, электроосаждение и электролиз в промышленности.
Типы электролитов
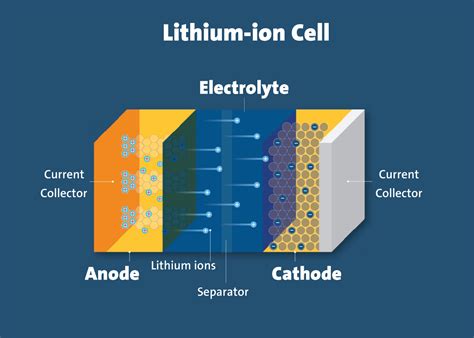
Электролиты – это вещества, которые в растворе обладают способностью проводить электрический ток. В зависимости от их происхождения и химических свойств, электролиты делят на несколько типов:
- Неорганические электролиты: данный тип электролитов состоит из ионов, образующихся при диссоциации некоторых неорганических соединений в растворах. Например, кислоты, основания и соли. Примером является хлористый натрий (NaCl).
- Органические электролиты: эти электролиты содержат органические соединения, которые также могут диссоциировать на ионы в растворе. Такие соединения обладают значительной молекулярной массой и могут быть как неполярными, так и поларными. Примером органического электролита является уксусная кислота.
- Электролиты в жидкой форме: некоторые вещества могут быть электролитами только в жидкой форме. Это могут быть, например, некоторые соли, металлические сплавы или расплавленные соли. В таких случаях электролиты передают электрический ток через свойства своей структуры и схемы движения ионов.
- Газовые электролиты: некоторые газы при высоких температурах и давлениях становятся электролитами. Это объясняется тем, что при таких условиях газы могут диссоциировать на положительно и отрицательно заряженные частицы, образуя ионы. Примером газового электролита является пар воды (H2O(g)).
Таким образом, различные типы электролитов обладают разнообразными свойствами и способностью проводить электрический ток, что имеет важное значение для проведения электрохимических реакций и функционирования различных электротехнических устройств.
Влияние растворов на электропроводность
Растворы играют важную роль в электропроводности, их свойства существенно влияют на электрический ток. Когда металлы проводят электрический ток, заряженные частицы - электроны - движутся свободно по металлической сетке. В случае с растворами, электропроводность обусловлена движением ионов, которые образуются в результате диссоциации электролита. Электролиты могут содержаться не только в растворах, но и в расплавах или жидкостях, в которых происходит ионизация вещества.
Растворы могут быть электролитическими и неэлектролитическими. Электролитический раствор содержит ионы, которые способны проводить электрический ток. Неэлектролитический раствор не содержит ионов, поэтому не может проводить электрический ток. От электропроводности электролитического раствора зависит его концентрация - чем больше ионов в растворе, тем выше его электропроводность. Кроме того, электропроводность электролитического раствора зависит от его температуры: с повышением температуры электропроводность увеличивается из-за увеличения движения ионов.
Влияние растворов на электропроводность также связано с тем, что ионы в растворах могут образовывать электролитические связи с электродами, что позволяет проводить электрический ток. Электроны, находящиеся на поверхности электрода, передаются ионам раствора, а ионы с электрода переходят в раствор. Это явление приводит к образованию двойного электрического слоя на границе раздела электрод-раствор. Таким образом, растворы имеют значительное влияние на электропроводность, предоставляя среду для передачи электрического тока между электродами.
Вопрос-ответ

Какие особенности есть у электропроводности металлов?
Одной из особенностей электропроводности металлов является наличие свободных электронов в их структуре. Эти свободные электроны обеспечивают свободную передачу электрического заряда по всему металлическому материалу. Это объясняет высокую электропроводность у металлов.
Чем отличается электропроводность металлов от электропроводности электролитов?
Основное отличие между электропроводностью металлов и электролитов заключается в природе переносимого заряда. В случае металлов, электрический заряд переносится свободными электронами. В случае электролитов, электрический заряд переносится ионами – положительно и отрицательно заряженными частицами, находящимися в растворе.
Какие принципы действия определяют электропроводность металлов?
Основными принципами, определяющими электропроводность металлов, является наличие свободных электронов и их способность свободно передвигаться внутри материала. Это связано с особенностями электронной структуры металлов, а именно наличием полностью заполненной зоны проводимости и частично заполненной зоны валентности.
В чем заключается разница в электропроводности металлов и электролитов?
Разница в электропроводности металлов и электролитов связана с природой переносимого заряда. В металлах электрический заряд переносится свободными электронами, которые могут свободно двигаться по всей структуре материала. В электролитах электрический заряд переносится ионами, которые находятся в растворе и могут перемещаться под воздействием электрического поля.
