Электроотрицательность – это химическая характеристика, которая определяет способность атома или иона притягивать электроны во время химической реакции. Водород имеет самую высокую электроотрицательность из всех элементов в периодической системе. Он является уникальным элементом, поскольку он имеет только один электрон в своей внешней оболочке. Благодаря этой высокой электроотрицательности, водород может образовывать ковалентные связи с различными элементами, включая металлы.
Металлы, с другой стороны, имеют обычно низкую электроотрицательность. Они обладают большим количеством свободных электронов в своей внешней оболочке, что делает их хорошими проводниками электричества и тепла. Однако, водород может образовывать особые соединения с металлами, такие как металлические гидриды, благодаря своей высокой электроотрицательности. Эти соединения обладают различными свойствами и находят применение в различных областях, включая катализ и электрохимическую энергетику.
В итоге, несмотря на низкую электроотрицательность металлов, водород играет важную роль в химических реакциях с металлами. Его высокая электроотрицательность делает его уникальным элементом, способным образовывать разнообразные химические соединения. Понимание и использование этих особенностей водорода и металлов открывает новые возможности для развития различных химических процессов и материалов.
Что такое электроотрицательность?

Электроотрицательность это характеристика атома или молекулы, которая определяет его способность притягивать электроны в химической связи. Чем выше значение электроотрицательности, тем сильнее атом или молекула притягивает электроны.
Электроотрицательность является важным понятием в химии, так как она помогает понять, как взаимодействуют атомы и молекулы при формировании химических связей. Высокая электроотрицательность может указывать на положительный ионы водорода (H+) и отрицательные ионы металлов. В случае, когда электроотрицательность водорода превосходит электроотрицательность металла, водород может образовывать ионические связи с металлами.
Интересно, что электроотрицательность элементов определяется множеством факторов, включая заряд ядра атома, количество электронных слоев и эффективность набора и потери электронов. Существуют различные шкалы электроотрицательности, такие как шкала Полинга и шкала Малкома-Роуза, которые измеряют электроотрицательность элементов в диапазоне от 0 до 4.
Примеры элементов с высокой электроотрицательностью:
- Кислород - электроотрицательность 3,44
- Фтор - электроотрицательность 3,98
- Хлор - электроотрицательность 3,16
Примеры элементов с низкой электроотрицательностью:
- Натрий - электроотрицательность 0,93
- Алюминий - электроотрицательность 1,61
- Серебро - электроотрицательность 1,93
Электроотрицательность является важным понятием при изучении свойств химических элементов и способов их взаимодействия в химических реакциях.
Определение и понятие электроотрицательности
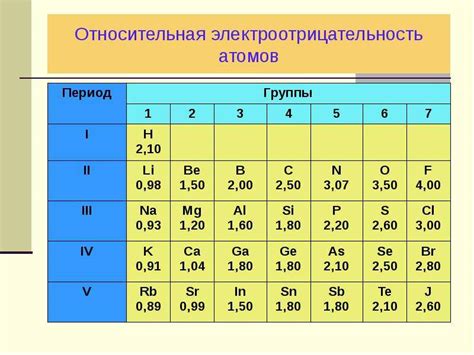
Электроотрицательность - это характеристика атома или химического элемента, указывающая на его склонность притягивать электроны к себе в химической связи. Введенное в 1932 году Линусом Полингом понятие электроотрицательности было разработано для объяснения свойств химических веществ и их реакций.
Электроотрицательность выражается числовым значением, которое может быть использовано для сравнительного анализа различных элементов. Чем выше значение электроотрицательности, тем сильнее элемент притягивает электроны. Самая высокая электроотрицательность имеет флуор, обладающий максимально возможным значением 4.0 по шкале Полинга.
Электроотрицательность имеет важное значение для понимания химической связи и реакций между атомами. Она определяет, как электроны распределены в молекулах, влияет на их полюсность и способность образовывать связи с другими атомами. Когда атом с более высокой электроотрицательностью связывается с атомом с более низкой электроотрицательностью, образуется полярная связь.
Важно отметить, что электроотрицательность может варьироваться в зависимости от контекста и используемой шкалы. В настоящее время существует несколько шкал электроотрицательности, включая шкалу Полинга и шкалу Маллоу. Они различаются по способу измерения и интерпретации электроотрицательности элементов.
Как измеряется электроотрицательность?

Электроотрицательность — это величина, которая характеризует способность атома притягивать к себе общие электроны в химической связи. Она измеряется по шкале электроотрицательности, разработанной учеными Полингом и Маллори итерациями.
Для оценки электроотрицательности использовано множество различных методов, однако наиболее распространенным является метод Полинга, основанный на определении химического свойства водорода. В этом методе электроотрицательность водорода определена как 2,1, а электроотрицательность других элементов измеряется относительно водорода.
Другим методом измерения электроотрицательности является метод ограничения Периода-Тренда. Согласно этому методу, электроотрицательность элементов возрастает отлития к вправо и от верха к низу периодической таблицы элементов.
- Метод Полинга основан на определении электроотрицательности водорода
- Метод ограничения Периода-Тренда позволяет определить электроотрицательность по положению элемента в периодической таблице
Используя данные, полученные с помощью этих методов, электроотрицательность разных элементов можно сравнивать и классифицировать их свойства по химической реакции в различных соединениях. Знание электроотрицательности элементов помогает определить химическую активность элементов и предсказать их поведение во время образования связей и реакций.
Водород как химический элемент

Водород (H) - это первый элемент периодической системы химических элементов. Он принадлежит к группе алкалиновых металлов, но его электроотрицательность превышает электроотрицательность большинства металлов. Водород имеет атомный номер 1 и находится в первом периоде таблицы.
У атома водорода один электрон и один протон. Его массовое число равно 1,00784 университетских атомных массы. Водород находится в газообразном состоянии при комнатной температуре и давлении. Он является наиболее распространенным элементом во Вселенной.
Водород имеет множество применений в различных отраслях науки и промышленности. Он используется в качестве горючего в ракетных двигателях и водородных топливных элементах, которые являются энергоэффективными и экологически чистыми источниками энергии.
Водород также используется в процессе синтеза аммиака, который является одним из основных компонентов удобрений. Он может быть использован в химической промышленности для производства различных органических и неорганических соединений. Водород также широко применяется в процессе глубокой переработки нефти и при производстве стекла и металлов.
Водород также играет важную роль в биохимии и физиологии. Он является ключевым элементом воды, основного составного элемента живых организмов. Ионизированный водород (протоны) участвует в процессе фотосинтеза и клеточного дыхания.
Особенности водорода в периодической таблице
Водород – первый элемент в периодической таблице, обладающий множеством уникальных свойств. Он является легким и самым простым химическим элементом, состоящим из одного электрона и одного протона.
Одной из особенностей водорода является его возможность образовывать связи как с металлами, так и с неметаллами. Находясь с левой стороны периодической таблицы, водород имеет электроотрицательность, превышающую электроотрицательность многих металлов.
Это позволяет водороду образовывать соединения с несколькими металлами, включая щелочные и щелочноземельные металлы. С другой стороны, водород также способен образовывать связи с неметаллами, превращаясь в катион. Благодаря этим особенностям, водород может входить в состав различных химических соединений, обеспечивая их разнообразие и широкое применение в различных областях.
Водород также обладает способностью к образованию межмолекулярных водородных связей, что играет важную роль во многих сферах жизни, например, в структуре белков и водахорошей. Это является одной из причин, почему водород так важен для жизни на Земле.
В итоге, водород является уникальным элементом периодической таблицы, обладающим свойствами, которые делают его неотъемлемой частью химии и жизни в целом.
Электроотрицательность водорода
Электроотрицательность водорода – одна из важных характеристик данного элемента. Электроотрицательность – это способность атома притягивать к себе электроны в химических связях. Для водорода эта величина составляет 2,20 по шкале Полинга.
Электроотрицательность водорода играет важную роль в химических реакциях со многими другими элементами. По своей природе водород может быть как электронным донором, так и акцептором, что определяется его электроотрицательностью. Большая электроотрицательность водорода позволяет ему образовывать ковалентные связи с металлами, что отличает его от других неметаллов.
В ряде соединений, вода, например, водород проявляет типичные неметаллические свойства, такие как амфотерность и возможность образования водородных связей. Электроотрицательность водорода является одной из причин его высокой подвижности и важности для органической химии.
Металлы и их химические свойства

Металлы - это группа химических элементов, обладающих определенными уникальными свойствами. Одним из основных химических свойств металлов является их способность образовывать ионы положительного заряда, так называемые катионы. Это связано с тем, что металлы имеют низкую электроотрицательность.
Электроотрицательность - это характеристика способности атома притягивать к себе электроны в химической связи. Водород, находящийся справа от металлов в периодической системе, обладает высокой электроотрицательностью, поэтому водородный атом при контакте с металлом образует отрицательно заряженный анион.
Электроотрицательность водорода превышает электроотрицательность металла, что обусловливает различие в химическом поведении этих элементов. Водород обладает способностью образовывать сильные ковалентные связи с неметаллами, в то время как металлы образуют металлические связи, основанные на обмене свободными электронами.
Металлы также проявляют свойства металлического блеска, хорошей теплопроводности и электропроводности. Они обладают высокой пластичностью и прочностью, что позволяет использовать их в различных отраслях промышленности, например, в производстве металлических изделий и строительных конструкций.
Кроме того, металлы способны образовывать сплавы с другими металлами, что расширяет их использование в различных технологических процессах. Сплавы металлов могут изменять свои физические и химические свойства, что делает их незаменимыми материалами в производстве авиационной, автомобильной и электротехнической отраслей.
Определение и основные свойства металлов

Металлы - это класс химических элементов с особыми физическими и химическими свойствами. Они обладают высокой термической и электрической проводимостью, а также отличаются пластичностью и прочностью.
Термическая и электрическая проводимость являются одними из основных свойств металлов. Благодаря свободному движению электронов, металлы способны передавать тепло и электрический ток с высокой эффективностью. Это делает металлы незаменимыми материалами в различных областях, включая электротехнику, электронику и строительство.
Пластичность - еще одно важное свойство металлов. Благодаря способности к деформации без разрушения, металлы могут быть легко прокатаны или иным образом обработаны для создания различных форм и изделий. Это делает металлы идеальными материалами для производства различных конструкций и инженерных изделий.
Кроме того, металлы обладают прочностью – свойством, позволяющим им выдерживать механические нагрузки без деформации или разрушения. Это делает металлы незаменимыми для создания прочных и долговечных материалов, используемых, например, в авиации, автомобилестроении и судостроении.
Таким образом, металлы - это класс веществ с уникальными свойствами, такими как термическая и электрическая проводимость, пластичность и прочность. Эти свойства делают металлы важными и широко используемыми материалами в различных областях науки, техники и промышленности.
Вопрос-ответ

Что такое электроотрицательность водорода и металла?
Электроотрицательность - это величина, характеризующая способность атома или иона привлекать к себе электроны в химической связи. Водород и металлы имеют различную электроотрицательность: у водорода она выше, а у металлов она ниже.
Почему электроотрицательность водорода выше, чем электроотрицательность металла?
Причиной высокой электроотрицательности водорода является его малая размерность и высокая электронегативность. Водород сильно притягивает электроны в химических связях и имеет большую склонность к образованию ионов. Металлы, напротив, имеют большие размеры и меньшую электроотрицательность, что делает их менее способными привлекать электроны в связях.
