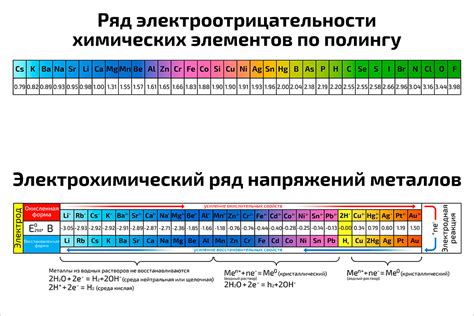
Электроотрицательность — это свойство атомов притягивать к себе электроны в связи. Один из способов оценки электроотрицательности элементов — использование таблицы электроотрицательности Малера. В ней каждому элементу присваивается численное значение, которое отображает его способность притягивать электроны. Электроотрицательность щелочных металлов — то есть элементов первой группы периодической системы, таких как литий, натрий, калий и т. д. — является одной из основных характеристик этих элементов.
Щелочные металлы характеризуются низкой электроотрицательностью, что означает их большую склонность отдавать электроны и образовывать положительно заряженные ионы. Это свойство обусловлено тем, что в этих элементах орбитали внешнего электронного слоя максимально заполнены электронами, что делает их недостаточно защищенными от внешних влияний. Как следствие, электроотрицательность щелочных металлов находится на очень низком уровне.
Электроотрицательность щелочных металлов играет особую роль в химических реакциях и свойствах этих элементов. Благодаря своей низкой электроотрицательности, они обладают высокими потенциалами солевых растворов, что делает их очень реакционноспособными. Другими словами, щелочные металлы проявляют высокую активность во взаимодействии с различными веществами, особенно водой. Таким образом, знание электроотрицательности щелочных металлов позволяет лучше понять их физико-химические свойства и применение в различных областях науки и техники.
Электроотрицательность щелочных металлов
Щелочные металлы – это элементы группы I периодической системы Менделеева. К этой группе относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Одной из основных характеристик этих металлов является их электроотрицательность.
Электроотрицательность – это химическая характеристика, описывающая способность атома притягивать к себе электроны в химической связи. Чем выше электроотрицательность элемента, тем сильнее он привлекает электроны. Важно отметить, что электроотрицательность имеет шкалу – шкалу Полинга – на которой значения изменяются от 0 до 4. Электроотрицательность увеличивается от левого верхнего угла периодической системы к правому нижнему углу.
Щелочные металлы обладают очень низкой электроотрицательностью. Наиболее низкая электроотрицательность в этой группе у франция (Fr) – 0,7. Это означает, что он слабо притягивает электроны в химической связи. На следующих местах по убыванию электроотрицательности находятся цезий (Cs) – 0,8, рубидий (Rb) – 0,8, калий (K) – 0,8, натрий (Na) – 0,9 и литий (Li) – 1. Таким образом, щелочные металлы обладают слабой способностью притягивать электроны и, следовательно, высокой реакционной активностью.
Из-за низкой электроотрицательности щелочные металлы образуют ионные соединения с элементами с более высокой электроотрицательностью. Они легко отдают свои внешние электроны, образуя положительно заряженные ионы. Эти ионы становятся источником высокой реакционной активности щелочных металлов.
Таблица электроотрицательности щелочных металлов

Электроотрицательность - это физическая величина, характеризующая способность атома вещества притягивать электроны в химической связи. Щелочные металлы являются группой элементов, отличающихся своей низкой электроотрицательностью. В таблице представлены значения электроотрицательности для щелочных металлов.
| Элемент | Электроотрицательность |
|---|---|
| Литий (Li) | 0.98 |
| Натрий (Na) | 0.93 |
| Калий (K) | 0.82 |
| Рубидий (Rb) | 0.82 |
| Цезий (Cs) | 0.79 |
На основе данной таблицы можно сделать выводы о том, что электроотрицательность щелочных металлов возрастает с увеличением атомного номера элемента. Литий имеет наименьшую электроотрицательность среди щелочных металлов, а цезий - наибольшую. Это связано с тем, что чем больше атом, тем сильнее он притягивает электроны. Электроотрицательность щелочных металлов определяет их свойства, включая реакционную способность и способность образовывать ионы.
Низкая электроотрицательность щелочных металлов позволяет им легко отдавать свои внешние электроны и участвовать в химических реакциях, особенно в реакциях с элементами с высокой электроотрицательностью. Это свойство делает щелочные металлы хорошими реагентами, которые широко используются в различных отраслях химической промышленности и научных исследованиях.
Периодическая система и электроотрицательность щелочных металлов

Периодическая система химических элементов подразделяет все известные химические элементы на группы, включая группу щелочных металлов. Щелочные металлы находятся в первой группе таблицы и включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Эти металлы характеризуются высокой активностью, воспламеняемостью и низкой плотностью.
Электроотрицательность - это характеристика атома, отображающая его способность притягивать электроны в химической связи. Щелочные металлы имеют низкую электроотрицательность, что делает их очень реактивными. По сравнению с другими элементами, щелочные металлы имеют низкую электроотрицательность, что означает, что они имеют сильную тенденцию отдавать электроны при реакциях.
Также стоит отметить, что электроотрицательность щелочных металлов возрастает с увеличением атомного номера внутри группы. Например, литий имеет самую низкую электроотрицательность среди щелочных металлов, а франций - самую высокую. Это связано с увеличением эффективной зарядности ядра атома и увеличением его радиуса.
Электроотрицательность щелочных металлов влияет на их химические свойства и способность образовывать ионные соединения. Благодаря низкой электроотрицательности, щелочные металлы могут легко отдать свой последний электрон, что делает их ионы положительно заряженными. Это свойство щелочных металлов приводит к формированию сильно основных соединений с кислотами и другими электроотрицательными элементами.
Химические свойства щелочных металлов, обусловленные электроотрицательностью
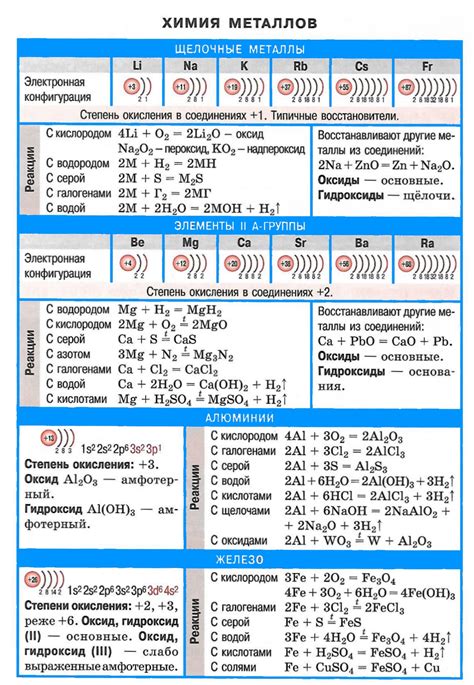
Щелочные металлы – это элементы первой группы периодической системы, включающие литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они обладают высокой электроотрицательностью, что делает их химически активными элементами.
Электроотрицательность щелочных металлов определяет их способность к образованию ионов, а также реактивность их соединений. Благодаря низкой электроотрицательности, щелочные металлы легко отдают свой внешний электрон, образуя положительно заряженные ионы. Это делает их ионами катионов, что обусловливает их активную реакционную способность.
Электроотрицательность щелочных металлов также влияет на их способность к образованию солей. Поскольку они обладают низкой электроотрицательностью, они образуют соли с кислородными и не кислородными кислотами. Например, натрий, обладающий наименьшей электроотрицательностью в группе, может образовывать соли не только с кислородными соединениями, но и с азотными, фосфорными и сероводородными кислотами.
Кроме того, электроотрицательность влияет на реакцию щелочных металлов с водой. Щелочные металлы реагируют с водой, образуя щелочные растворы и выделяя водород. Процесс реакции зависит от электроотрицательности элемента – более электроотрицательные элементы, такие как литий и натрий, более активно взаимодействуют с водой.
Области применения щелочных металлов и их электроотрицательность

Щелочные металлы – это элементы периодической таблицы, включающие литий (Li), натрий (Na), калий (K), рубидий (Rb) и цезий (Cs). Они обладают низкой электроотрицательностью, что означает, что они имеют высокую способность отдавать электроны. Их электроотрицательность уменьшается с увеличением атомного номера в группе.
Из-за своей низкой электроотрицательности, щелочные металлы широко используются в различных областях. Например, литий применяется в производстве легких батарей, так как отдача электрона позволяет создать большую разность потенциалов. Натрий используется в пищевой промышленности для консервирования и приготовления пищи, а также в производстве стекла и мыла.
Калий является необходимым элементом для растений и используется в сельском хозяйстве как удобрение. Рубидий и цезий находят применение в электронике и в научных исследованиях, в частности в атомной физике.
Электроотрицательность щелочных металлов определяет их химические свойства и способность образовывать соединения с другими элементами. Это позволяет использовать щелочные металлы в различных промышленных процессах и технологиях.
Влияние электроотрицательности щелочных металлов на химические реакции
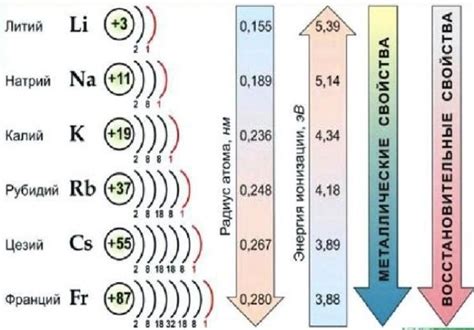
Электроотрицательность щелочных металлов играет важную роль в химических реакциях, определяя их характер и скорость. Электроотрицательность обусловлена способностью атомов притягивать электроны к себе и образованием ионов в процессе реакции.
Щелочные металлы, такие как литий, натрий и калий, обладают низкой электроотрицательностью, что означает, что они с большой легкостью отдают свои электроны другим атомам. Именно эта способность делает их химически активными и реакционноспособными.
Высокая активность щелочных металлов обусловлена их способностью образовывать ионы с положительным зарядом, которые затем реагируют с другими частицами, образуя новые вещества. Это особенно заметно в реакциях щелочных металлов с водой, где образуются щелочные гидроксиды и выделяется водород.
Электроотрицательность щелочных металлов также влияет на их способность образовывать соли. Благодаря своей низкой электроотрицательности, щелочные металлы легко образуют положительно заряженные ионы, которые соединяются с противоположно заряженными анионами других элементов, образуя ионо-молекулярные соединения.
В общем, электроотрицательность щелочных металлов определяет их химическую активность и способность участвовать в различных химических реакциях. Низкая электроотрицательность позволяет щелочным металлам быстро реагировать с другими веществами, образуя новые соединения и влияя на ход реакции.
Вопрос-ответ

Что такое электроотрицательность щелочных металлов?
Электроотрицательность - это химическая свойство атомов химических элементов притягивать к себе электроны в химической связи. Щелочные металлы - это элементы периодической системы, которые относятся к первой группе, такие как литий, натрий, калий и др.
Как измеряется электроотрицательность щелочных металлов?
Величина электроотрицательности щелочных металлов измеряется с использованием различных шкал, самой распространенной из которых является шкала Полинга.
Где я могу найти таблицу электроотрицательности щелочных металлов?
Таблица электроотрицательности щелочных металлов есть во многих учебниках химии и источниках информации в интернете, таких как сайты образовательных учреждений и химические энциклопедии.
Какова особенность электроотрицательности щелочных металлов?
Особенностью электроотрицательности щелочных металлов является их низкая электроотрицательность по сравнению с другими элементами.
Зачем нужно знать электроотрицательность щелочных металлов?
Знание электроотрицательности щелочных металлов важно для понимания и предсказания химических свойств и реакций, в которых они участвуют. Также это может быть полезно при изучении реакций и свойств других элементов и соединений, с которыми щелочные металлы могут вступать во взаимодействие.
