Щелочные металлы - это элементы первой группы периодической системы, которые включают в себя литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Эти элементы имеют низкую электроотрицательность, что означает их склонность отдавать электроны при химических реакциях. Однако, существуют способы увеличить электроотрицательность щелочных металлов и изменить их химические свойства.
Одним из методов увеличения электроотрицательности щелочных металлов является изменение их окружающей среды. Например, при добавлении этих металлов в смесь с другими веществами, они могут образовывать ионы с более высокой электроотрицательностью. Кроме того, возможно введение в щелочные металлы примесей других элементов, что может повысить их электроотрицательность.
Другим способом увеличения электроотрицательности щелочных металлов является изменение их структурной конфигурации. Например, ионы щелочных металлов могут образовывать комплексы с другими лигандами, что приводит к изменению их электроотрицательности. Кроме того, модификация кристаллической структуры щелочных металлов может также влиять на их химические свойства и электроотрицательность.
Увеличение электроотрицательности щелочных металлов может быть полезным для различных приложений в химической промышленности. Например, более электроотрицательные ионы щелочных металлов могут быть использованы для усиления каталитических реакций или улучшения проводимости материалов в электрохимических устройствах.
Влияние электроотрицательности на свойства щелочных металлов
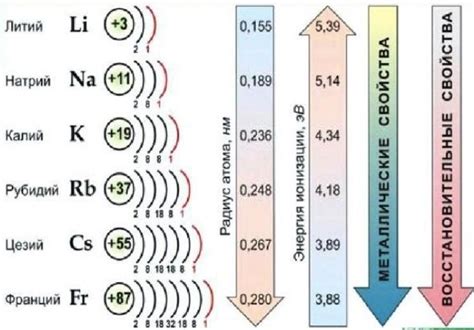
Электроотрицательность – это химический показатель, который характеризует способность атома притягивать к себе электроны в химической связи. Чем выше электроотрицательность атома, тем сильнее он способен притягивать электроны, что влияет на его химические свойства.
Щелочные металлы, такие как литий, натрий, калий и др., имеют низкую электроотрицательность, что делает их очень реактивными и химически активными элементами. Их атомы отдают легко свои электроны, образуют положительно заряженные ионы и образуют сильные щелочные растворы.
Из-за низкой электроотрицательности щелочные металлы имеют низкую энергию ионизации, то есть им не требуется большая энергия для отрыва электрона от атома. Это делает их отличными реагентами при взаимодействии с другими элементами и соединениями.
Важно отметить, что электроотрицательность может влиять на другие химические свойства щелочных металлов, такие как растворимость, плотность, температура плавления и кипения и т.д. Это обусловлено тем, что электроотрицательность влияет на положение элемента в периодической системе и его взаимодействие с другими элементами.
Таким образом, электроотрицательность имеет значительное влияние на свойства щелочных металлов, определяя их химическую активность, реакционную способность и способность образовывать различные соединения.
Увеличение электроотрицательности влияет на химические реакции

Электроотрицательность элементов играет важную роль в химических реакциях. Щелочные металлы характеризуются низкой электроотрицательностью, что обусловлено их строением электронных оболочек и наличием одного электрона в внешней оболочке. Однако, при увеличении электроотрицательности щелочных металлов, происходят изменения в их химическом поведении.
Увеличение электроотрицательности увеличивает способность щелочных металлов к принятию и передаче электронов. Электроотрицательность влияет на ионизацию щелочных металлов в растворах, их растворимость и химическую реакционную способность. Высокая электроотрицательность щелочных металлов приводит к образованию ионов с положительными зарядами, что позволяет им вступать в реакции с отрицательно заряженными ионами или молекулами.
Увеличение электроотрицательности также влияет на электронную плотность в молекуле щелочных металлов. При этом возникает градиент электронной плотности в молекуле, что приводит к изменению свойств и химической реакционной способности щелочных металлов. Это обусловлено тем, что электроотрицательность влияет на силу притяжения электронов к ядру атома, а также на возможность образования ковалентной связи между атомами.
В целом, увеличение электроотрицательности щелочных металлов ведет к увеличению их активности в химических реакциях. Они становятся более реакционноспособными и способными к образованию новых соединений.
Электроотрицательность и реактивность щелочных металлов

Электроотрицательность щелочных металлов является важной характеристикой, определяющей их реактивность и химические свойства. Щелочные металлы, такие как литий, натрий и калий, имеют очень низкую электроотрицательность, что делает их сильными восстановителями и ионными радикалами.
Из-за низкой электроотрицательности, щелочные металлы обладают высокой положительной зарядкой, что означает, что они легко отдают электроны другим элементам. Это делает их очень реактивными и способными образовывать ионы с отрицательной зарядкой.
Низкая электроотрицательность щелочных металлов также определяет их реакцию с водой. Они реагируют с водой, образуя щелочные гидроксиды и высвобождая водород. Это реакция является очень экзотермической и может быть сопровождена выбросом пламени.
Щелочные металлы также реагируют с кислородом, образуя оксиды, такие как оксид лития, оксид натрия и оксид калия. Это свидетельствует о сильной реактивности щелочных металлов и их способности образовывать стабильные соединения с кислородом.
В целом, электроотрицательность щелочных металлов является одним из ключевых факторов, определяющих их химические свойства и реактивность. Низкая электроотрицательность делает щелочные металлы очень реактивными и способными образовывать стабильные ионы и соединения с другими элементами.
Вопрос-ответ

Что такое электроотрицательность щелочных металлов?
Электроотрицательность щелочных металлов - это химическая характеристика, которая определяет способность атомов этих металлов притягивать к себе электроны при образовании химических связей. Чем выше электроотрицательность, тем сильнее элемент притягивает электроны.
В чем причина увеличения электроотрицательности щелочных металлов?
Увеличение электроотрицательности щелочных металлов связано с их положением в периодической системе. Щелочные металлы находятся слева в первой группе, где электроотрицательность элементов в общем возрастает от верхушки к основанию группы. Это связано с увеличением зарядов ядра атомов и уменьшением размеров атомов.
Какое значение электроотрицательности имеют щелочные металлы?
Значение электроотрицательности щелочных металлов зависит от конкретного элемента и может быть выражено числом. Например, для лития электроотрицательность составляет 0,98, для натрия - 0,93, для калия - 0,82 и т. д.
Как влияет увеличение электроотрицательности щелочных металлов на их химические свойства?
Увеличение электроотрицательности щелочных металлов обуславливает их большую реакционную способность. Более электроотрицательные элементы образуют более сильные иионные ковалентные связи и сильнее взаимодействуют с другими элементами. Это влияет на их способность образовывать соединения и участвовать в химических реакциях.
