Электроотрицательность является одной из ключевых характеристик элементов, определяющей их химическую активность и способность образовывать химические связи. Неметаллы и металлы являются двумя основными группами элементов, причем электроотрицательность неметаллов обычно выше, чем электроотрицательность металлов.
Причина этого различия заключается в строении атомов неметаллов и металлов. Атомы неметаллов имеют относительно небольшой радиус и большое количество незавязанных электронов во внешней оболочке. Это делает их атомы более электроотрицательными, поскольку они сильнее притягивают к себе электроны во время химических реакций.
В отличие от этого, металлы имеют большой радиус и малое количество электронов во внешней оболочке. В результате, они имеют более низкую электроотрицательность и облегчают передачу электронов в более электроотрицательные элементы во время образования химических связей.
В целом, электроотрицательность неметаллов и металлов объясняет различия в их химических свойствах и реакционной способности. Неметаллы, благодаря своей высокой электроотрицательности, обладают большей активностью и склонностью образовывать ионные и ковалентные химические связи с другими элементами.
Принципиальные различия в электроотрицательности неметаллов и металлов

Электроотрицательность — это показатель способности атома неметалла притягивать к себе электроны в химической связи. Она является одним из важных факторов, определяющих химическую активность вещества. Отличительной особенностью неметаллов является более высокая электроотрицательность по сравнению с металлами.
Основными причинами превышения электроотрицательности неметаллов над металлами являются следующие:
- Строение электронной оболочки. Атомы неметаллов имеют малое количество электронов в внешней оболочке, что делает их более активными в химических реакциях. В то время как атомы металлов имеют более широкую электронную оболочку и меньший притягивающий эффект на электроны.
- Отношение к ионизации. Неметаллы имеют большую склонность к ионизации, то есть к образованию ионов. Это связано с их высокой электроотрицательностью, которая притягивает электроны и способствует образованию отрицательно заряженных ионов.
- Отношение к окислению. Восстановительные свойства металлов обусловлены их низкой электроотрицательностью, что позволяет им с легкостью отдавать электроны и становиться положительно заряженными ионами. В отличие от них, неметаллы имеют высокую электроотрицательность, что позволяет им легко вступать в окислительные реакции и принимать электроны, образуя отрицательно заряженные ионы.
В результате этих различий в электроотрицательности, неметаллы и металлы демонстрируют разные химические свойства и способность образовывать стабильные химические связи. Поэтому неметаллы имеют большую склонность к образованию соединений с металлами, а металлы, наоборот, обладают способностью отдавать электроны и образовывать положительно заряженные ионы.
Понятие и значение электроотрицательности
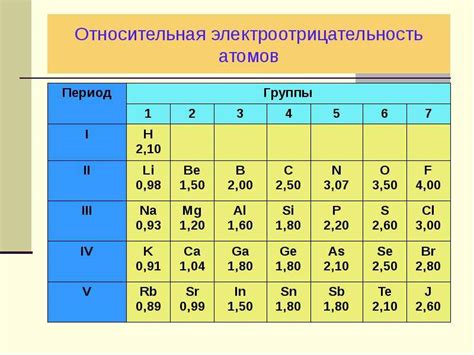
Электроотрицательность - это химическая характеристика атома, описывающая его способность притягивать электроны в химической связи. Электроотрицательность является важным параметром, определяющим глобальные химические свойства данного химического элемента и его реакционную активность.
Значение электроотрицательности важно для понимания химических связей между атомами. Чем выше электроотрицательность атома, тем сильнее он притягивает электроны связи к себе. Это значит, что более электроотрицательный элемент обладает большей способностью привлекать электроны связи и удерживать их ближе к своей валентной оболочке. Возникающая электронная асимметрия приводит к появлению полярности в химической связи, что в свою очередь влияет на различные химические и физические свойства вещества.
Электроотрицательность имеет важное значение в определении типа химической связи. Если разница величины электроотрицательности между двумя атомами в молекуле незначительна, то связь между ними будет неполярной координационной. Если же разница величины электроотрицательности достаточно велика, то связь будет полярной, а в случае сильной разницы величин электроотрицательности возможно образование ионной связи.
Взаимодействие атомов в химических соединениях

Взаимодействие атомов в химических соединениях определяется электроотрицательностью элементов. Электроотрицательность - это способность атома притягивать к себе электроны в химической связи. Неметаллы обладают более высокой электроотрицательностью по сравнению с металлами, что связано с их электронной структурой и положением в периодической системе элементов.
Атомы неметаллов, такие как кислород, азот и хлор, имеют большую электроотрицательность. Это связано с тем, что у них большое количество электронов в валентной оболочке, что влечет за собой большую силу притяжения к ядру атома. Неметаллы стремятся принять электроны от других атомов, чтобы достичь стабильной октетной конфигурации.
Металлы, напротив, имеют меньшую электроотрицательность, так как у них мало электронов в валентной оболочке. Они имеют тенденцию отдавать электроны другим атомам, чтобы достигнуть стабильной конфигурации с полностью заполненной внешней оболочкой. Таким образом, металлы обычно образуют ионы, положительно заряженные катионы.
Электроотрицательность играет важную роль в образовании химических связей. Атомы с большей электроотрицательностью притягивают электроны с большей силой и формируют отрицательно заряженные анионы, в то время как атомы с меньшей электроотрицательностью образуют положительно заряженные ионы. Эта разница в электроотрицательности приводит к образованию ионных, координационных и ковалентных связей между атомами в химических соединениях.
Сравнение электроотрицательности неметаллов и металлов

Электроотрицательность - свойство атома притягивать к себе электроны, когда он участвует в химических связях. Неметаллы обладают высокой электроотрицательностью, в то время как металлы имеют низкую электроотрицательность. Это различие обусловлено их разными физическими и химическими свойствами.
Высокая электроотрицательность неметаллов связана с их строением атома. Неметаллические атомы имеют большое количество электронов в своих внешних энергетических оболочках и стремятся заполнить их за счет приобретения дополнительных электронов. Это обусловлено более высокой энергией этих оболочек и большей энергией привлекательной силы ядра к электронам. Таким образом, неметаллы имеют большую аффинность к электронам и могут с легкостью привлекать их к себе.
Наоборот, металлы имеют малое количество электронов во внешней энергетической оболочке и стремятся отдавать лишние электроны, чтобы достичь стабильности. Это связано с меньшей энергией связи внешних электронов с ядром и большей расстяжимостью в электронной оболочке. Металлы обычно образуют положительно заряженные ионы и слабо притягивают электроны.
Следует также отметить, что существует периодическая тенденция электроотрицательности в периоде и группе таблицы Менделеева. Внутри группы электроотрицательность увеличивается с увеличением атомного номера, а внутри периода электроотрицательность увеличивается с увеличением энергии оболочки.
В целом, электроотрицательность неметаллов превышает электроотрицательность металлов из-за различий в строении атомов и их способности притягивать электроны. Это свойство играет важную роль в химических свойствах веществ и их способности образовывать соединения.
Связь между электроотрицательностью и положением элементов в периодической таблице
Электроотрицательность является важной характеристикой элементов, которая позволяет определить их способность привлекать электроны в химической связи. При изучении периодической таблицы Менделеева можно заметить, что электроотрицательность неметаллов, в целом, превышает электроотрицательность металлов.
Связь между электроотрицательностью и положением элементов в периодической таблице обусловлена электронной структурой атомов. Неметаллы, расположенные в правой части периодической таблицы, имеют большую электроотрицательность, так как они имеют мало электронов в внешнем энергетическом уровне и стремятся заполнить его. Это обуславливает их способность к привлечению электронов и образованию ковалентных связей.
В то же время, металлы, расположенные в левой части таблицы, имеют меньшую электроотрицательность. Они имеют малое количество электронов во внешнем энергетическом уровне и готовы отдать эти электроны, образуя ионные связи с неметаллами. Ионные связи характерны для соединений, в которых металлы и неметаллы обменивают электроны, образуя ионы разных зарядов.
Таким образом, положение элементов в периодической таблице прямо влияет на их электроотрицательность, которая является важным фактором при определении химических свойств и реакционной способности элементов.
Влияние строения атомов на их электроотрицательность

Электроотрицательность атомов зависит от их строения и расположения электронов в электронных оболочках. Неметаллы обладают более высокой электроотрицательностью по сравнению с металлами, так как у них часто присутствуют маленькие атомные радиусы, которые обуславливают сильное притяжение электронов ядрами.
Неметаллические атомы имеют больший размер по сравнению с металлическими атомами, из-за чего у них большая эффективная зарядность ядра. Кроме того, в неметаллах электроны занимают энергетически более высокие уровни, что приводит к более сильной электроотрицательности веществ.
Структурное строение атомов также играет роль в определении электроотрицательности. Положение элементов в периодической системе, их валентная оболочка и связывающие электроны влияют на электроотрицательность атомов.
Наличие у неметаллов более высокой электроотрицательности обуславливает их способность привлекать электроны к себе, что ведет к образованию ковалентной связи. Это также объясняет химическую активность неметаллов и их способность образовывать соединения с металлами, обладающими более низкой электроотрицательностью.
Причины, определяющие высокую электроотрицательность неметаллов

1. Электронная конфигурация: Одной из основных причин, определяющих высокую электроотрицательность неметаллов, является их электронная конфигурация. Неметаллы обладают недостатком электронов в внешней оболочке, что приводит к стремлению заполнить ее за счет электронов из других атомов.
2. Высокая энергия ионизации: Неметаллы обладают высокой энергией ионизации, что означает, что им требуется большая энергия, чтобы удалить электрон из их внешней оболочки. Благодаря этому они обладают сильным стремлением принимать электроны от других атомов, что существенно повышает их электроотрицательность.
3. Малый радиус атома: Размер атома является еще одним фактором, влияющим на электроотрицательность. Неметаллы имеют более маленький радиус по сравнению с металлами, что делает их оболочку ближе к ядру и более сильно притягивает электроны.
4. Сила взаимодействия атомов: Неметаллы обычно образуют ковалентные связи с другими атомами, в результате чего происходит сильное обменное взаимодействие электронов. Этот обмен электронами приводит к положительному заряду ядра и отрицательному заряду оболочки, что усиливает электроотрицательность неметаллов.
5. Положительный заряд ядра: Неметаллы имеют больший положительный заряд ядра в сравнении с металлами. Это также влияет на их способность притягивать электроны и делает неметаллы более электроотрицательными.
Практическое применение понятия электроотрицательности

Понятие электроотрицательности имеет широкое применение в химии и физике и играет важную роль в понимании свойств веществ и реакций между ними.
Электроотрицательность позволяет определить положение элементов в периодической системе, а также предсказать химическую активность веществ. Более электроотрицательные элементы обладают большей способностью притягивать электроны в химических связях, что делает их более активными в реакциях.
Понятие электроотрицательности используется для предсказания типа химической связи между атомами. Если разница в электроотрицательности между атомами большая, то связь будет главным образом ионной или полярной, а если разница мала, то связь будет главным образом ковалентной.
Также электроотрицательность используется для определения полярности молекул. Если в молекуле разница в электроотрицательности между атомами большая, то молекула будет полярной, а если разница мала или отсутствует, то молекула будет неполярной.
Понятие электроотрицательности находит применение и в определении степени окисления атомов в веществах. Более электроотрицательные элементы имеют положительное значение степени окисления, а менее электроотрицательные элементы - отрицательное значение.
Таким образом, понятие электроотрицательности является неотъемлемой частью химической науки и позволяет предсказывать свойства веществ и реакции между ними, а также определять структуру и тип связей в химических соединениях.
Значимость различий в электроотрицательности для формирования химических связей
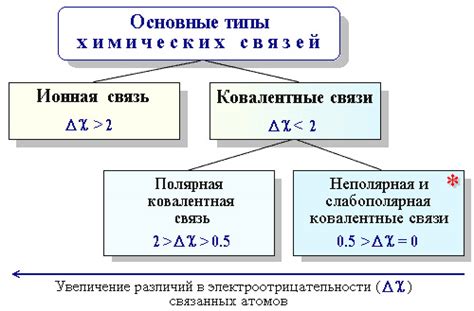
Различия в электроотрицательности неметаллов и металлов являются ключевыми факторами при формировании химических связей. Электроотрицательность описывает способность атома притягивать электроны к себе в химической связи. Неметаллы обладают высокой электроотрицательностью, что делает их сильными "электронными грабителями". Это означает, что они стремятся привлечь электроны от других атомов для достижения более стабильной валентной оболочки. В то же время, металлы имеют низкую электроотрицательность и более "щедры" в отношении электронов.
Различия в электроотрицательности определяют характер химической связи между атомами. Если разница в электроотрицательности между двумя атомами вещества незначительна, то образуется неполярная ковалентная связь. В этом случае электроны общих пар между атомами практически равномерно распределены и валентная оболочка каждого атома остается нейтральной. В то время как в более полюсной ковалентной связи с большой разницей в электроотрицательности, электроны смещаются ближе к атому с более высокой электроотрицательностью.
Разница в электроотрицательности также может определять тип химической связи между атомами. Если разница в электроотрицательности достаточно большая, то может образоваться ионная связь. В этом случае один атом, обладающий меньшей электроотрицательностью, становится положительно заряженным ионом (катионом), а атом с большей электроотрицательностью становится отрицательно заряженным ионом (анионом). Ионы притягиваются друг к другу с помощью электростатических сил, образуя кристаллическую решетку в ионной соединении.
Кроме того, различия в электроотрицательности могут влиять на реакционную активность веществ. Неметаллы, обладающие высокой электроотрицательностью, часто являются более активными в реакциях, так как они легко принимают дополнительные электроны для достижения стабильной валентной оболочки. Металлы, с другой стороны, могут быть менее реактивными, так как они имеют тенденцию отдавать электроны.
Вопрос-ответ

Зачем неметаллам высокая электроотрицательность?
Высокая электроотрицательность неметаллов обусловлена их строением атомов и электронной конфигурацией. Неметаллы имеют более сложную атомную структуру и большее количество электронов в валентной оболочке, что делает их более "голодными" на электроны. Электроотрицательность неметаллов позволяет им притягивать электроны от других атомов и образовывать ковалентные связи.
Почему металлы имеют низкую электроотрицательность?
Металлы имеют низкую электроотрицательность, так как их атомы имеют меньшее количество электронов в валентной оболочке, а также более распределенные электронные облака. Это делает металлы менее "голодными" на электроны, поэтому они склонны отдавать свои электроны другим атомам и образовывать ионные связи.
