Электроотрицательность - это химическая характеристика атома, отражающая его способность притягивать к себе электроны в молекуле. Она играет важную роль в химических реакциях и свойствах вещества. Металлы и неметаллы имеют различные значения электроотрицательности, что определяет их взаимодействие и свойства.
Металлы, как правило, имеют малую электроотрицательность. Это связано с их способностью легко отдавать электроны и образовывать положительные ионы. Поэтому металлы хорошо проводят электричество и тепло, имеют блестящую поверхность и образуют металлические связи. Например, металл натрий имеет низкую электроотрицательность, что делает его хорошим проводником электричества и главным компонентом в производстве алюминия и стекла.
Неметаллы, наоборот, имеют высокую электроотрицательность и, следовательно, большую способность притягивать электроны к себе. Это делает неметаллы плохими проводниками электричества и тепла. Они обычно образуют отрицательные ионы и образуют ковалентные связи. Например, неметалл хлор имеет высокую электроотрицательность, что делает его хорошим окислителем и одним из основных компонентов пищеварительных солей.
Таким образом, электроотрицательность металлов и неметаллов выполняет различные функции в химических реакциях. Металлы и неметаллы проявляют различные свойства и взаимодействуют друг с другом с учетом их электроотрицательности.
Понятие "электроотрицательность"

Электроотрицательность – это характеристика атома, которая определяет его способность притягивать электроны в химической связи. Электроотрицательность является одним из важных параметров, описывающих химические свойства элементов.
Электроотрицательность обычно измеряется по шкале Полинга или Мюллера-Шарплесса, и значения электроотрицательности варьируют от 0 до 4. Чем больше значение электроотрицательности элемента, тем сильнее он притягивает электроны в химической связи.
На основе значений электроотрицательности элементов можно определить их химические свойства, такие как способность образовывать ионные связи или ковалентные связи. Элементы с высокими значениями электроотрицательности, например, неметаллы, обычно образуют ковалентные связи, в то время как элементы с низкими значениями электроотрицательности, например, металлы, образуют ионные связи.
Электроотрицательность также влияет на полярность молекул и межмолекулярные силы. Если разность электроотрицательности в молекуле значительна, то эта молекула будет полярной. Полярные молекулы обладают дипольным моментом и проявляют свойства, такие как растворимость в полярных растворителях и способность образовывать водородные связи.
Таблица электроотрицательностей элементов помогает визуально сравнить значение электроотрицательности различных элементов и определить их порядок в ряду по возрастанию или убыванию. Знание электроотрицательности элементов является важным при изучении химических связей, соединений и реакций.
Металлы и неметаллы: основные различия

Металлы и неметаллы - это две основные категории химических элементов, которые имеют существенные различия в своих физических и химических свойствах.
Физические свойства:
- Проводимость электричества: металлы обладают высокой электропроводностью, тогда как неметаллы - слабые проводники или непроводники.
- Относительная твердость: металлы обычно твердые или пластичные, тогда как неметаллы могут быть твердыми, жидкими или газообразными.
- Плотность: металлы обычно обладают большей плотностью, чем неметаллы.
Химические свойства:
- Электроотрицательность: металлы имеют низкую электроотрицательность, тогда как неметаллы имеют высокую электроотрицательность.
- Способность образовывать ионные связи: металлы имеют тенденцию образовывать положительно заряженные ионы (катионы), тогда как неметаллы образуют отрицательно заряженные ионы (анионы).
- Реактивность: металлы в общем случае более реактивны, чем неметаллы. Они часто образуют соли, оксиды и гидроксиды.
Области применения:
Металлы широко используются в промышленности для производства металлических изделий, строительных материалов и электроники. Неметаллы находят свое применение в производстве пластмасс, керамики, стекла и полупроводников.
Таким образом, металлы и неметаллы являются основными классами элементов, которые имеют отличия в своих физических и химических свойствах, способности проводить электричество, их реактивности и областях применения.
Электроотрицательность металлов

Электроотрицательность - это характеристика атома, отражающая его способность притягивать электроны к себе в химической связи. Чем больше электроотрицательность атома, тем большее его притягивающее действие на электроны. Однако металлы обладают низкой электроотрицательностью по сравнению с неметаллами.
Металлы, как правило, имеют малую электроотрицательность и склонность отдавать электроны при образовании химических связей. Это свойство позволяет металлам образовывать ионные и металлические связи с неметаллами и другими металлами. Металлическая связь основана на свободной подвижности электронов в кристаллической решетке металла.
Металлы хорошо проводят ток, так как свободные электроны могут без препятствий перемещаться в металлической структуре. Благодаря низкой электроотрицательности металлы обладают высокой термической и электрической проводимостью, что делает их востребованными в различных отраслях промышленности.
Важность электроотрицательности металлов

Электроотрицательность металлов - это важный химический параметр, который определяет способность атомов металлов притягивать электроны в бондах с другими атомами. Чем выше электроотрицательность металла, тем сильнее он притягивает электроны и тем больше вероятность, что он образует ионные связи с неметаллами.
Высокая электроотрицательность металлов имеет ряд важных практических применений. Один из примеров - использование электроотрицательных металлов в катализаторах. Эти металлы к реагирующим веществам присоединяются через образование более сильных и устойчивых связей, что ускоряет химические реакции. Так, высокая электроотрицательность металлов, таких как платина или родий, обеспечивает эффективное функционирование катализаторов в процессах синтеза и очистки.
Кроме того, электроотрицательность металлов играет важную роль в электронной проводимости материалов. Высокая электроотрицательность способствует лучшей передаче электрического тока по металлическим проводам, что делает металлы востребованными материалами для проводов и электронных устройств.
Однако, химические свойства металлов с низкой электроотрицательностью также имеют практическое значение. Например, такие металлы, как алюминий и магний, обладают некоторыми уникальными свойствами, такими как легкость и прочность, благодаря их низкой электроотрицательности.
Различия в электроотрицательности металлов

Электроотрицательность металлов - это их способность привлекать электроны в химической связи. Она имеет свои особенности и различия от электроотрицательности неметаллов.
Во-первых, металлы имеют низкую электроотрицательность по сравнению с неметаллами. Это означает, что металлы имеют меньшую способность привлекать электроны. В связи с этим, металлы часто делятся на катионы, которые образуются, отдавая электроны в химических реакциях.
Во-вторых, металлы имеют высокую электропроводность. Это связано с их способностью легко перемещать электроны по своей кристаллической структуре. Благодаря этой способности, металлы обладают хорошей электропроводностью и довольно низким сопротивлением электрическому току.
Кроме того, металлы имеют свойства гибкости и пластичности. Это связано с их способностью к деформации без разрушения структуры. Перемещение электронов между атомами внутри металла позволяет ему подвергаться пластической деформации, что выполняет важную роль в процессе обработки металлов и создания из них различных конструкций.
Таким образом, различия в электроотрицательности металлов указывают на их особенности в химических и физических свойствах. Низкая электроотрицательность, высокая электропроводность и гибкость делают металлы важными и неотъемлемыми компонентами в различных отраслях промышленности и науки.
Электроотрицательность неметаллов

Электроотрицательность неметаллов является одной из основных характеристик, определяющих их химические свойства. Электроотрицательность - это способность атома неметалла притягивать электроны к себе в химической связи.
Неметаллы обладают высокой электроотрицательностью, что связано с их строением атомов. Атомы неметаллов имеют небольшой радиус и возможность образовывать ковалентные связи с другими атомами, что позволяет им притягивать электроны сильнее, чем металлы.
У неметаллов электроотрицательность возрастает в периоде с левого края таблицы Менделеева (галогены) к правому краю (инертные газы). Кроме того, неметаллы обычно обладают большим числом электронов, что также способствует высокой электроотрицательности.
Электроотрицательность неметаллов определяет их способность к образованию ионов и соединений. Неметаллы обычно образуют отрицательно заряженные ионы (анионы), такие как хлориды и оксиды.
Высокая электроотрицательность неметаллов также обусловливает их реактивность. Они обычно реагируют с металлами, образуя ионные соединения. Кроме того, неметаллы обладают высокой электроотрицательностью, что позволяет им образовывать ковалентные связи с другими неметаллами и образовывать молекулы, такие как вода и углекислый газ.
Важность электроотрицательности неметаллов

Электроотрицательность является важной характеристикой неметаллов и определяет их способность притягивать электроны при образовании химических связей. Она играет ключевую роль в формировании молекул и соединений, а также в определении их химических свойств.
Высокая электроотрицательность неметаллов указывает на их сильное стремление к заполнению своей внешней электронной оболочки, за счет захвата электронов от других атомов. В результате образуются ковалентные связи, где электроны общие для обоих атомов. Это объясняет химическую активность неметаллов и их способность образовывать различные соединения.
Электроотрицательность неметаллов также определяет их способность образовывать ионные связи с металлами. Неметаллы, с большей электроотрицательностью, притягивают электроны металла, что приводит к образованию ионов и образованию ионных соединений. Это делает неметаллы важными для образования солей, кислот и органических соединений.
Относительно высокая электроотрицательность неметаллов также обуславливает их способность приводить к полностью или частично ионизованным состояниям во взаимодействии с металлические элементами. В силу этого, неметаллические сильные окислители способны вызывать окислительные реакции с металлами.
Важность электроотрицательности неметаллов понятна при рассмотрении их широкого применения в промышленности, медицине и ежедневной жизни. Например, химическими реакциями между неметаллами и металлами получаются разнообразные материалы, включая пластик, стекло, полупроводники, а также различные добавки и лекарственные препараты.
Различия в электроотрицательности неметаллов
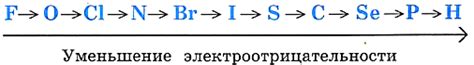
1. Электроотрицательность: Неметаллы обладают более высокой электроотрицательностью по сравнению с металлами. Электроотрицательность - это способность атома притягивать электроны к себе в химической связи. Высокая электроотрицательность неметаллов объясняет их способность к электронно-отрицательным реакциям.
2. Связывающая энергия: Неметаллы образуют ковалентные химические связи, которые характеризуются совместным использованием электронов. Это различается от металлов, которые обычно образуют ионные связи с передачей электронов. Ковалентные связи в неметаллах значительно сильнее, так как электроны обмениваются между атомами.
3. Физические свойства: Неметаллы обычно обладают низким температурным плавлением и кипением, по сравнению с металлами. Это объясняется слабостью связи между атомами неметаллов, что делает их более легкими для разделения. Неметаллы также часто обладают хрупкостью, непроводимостью электричества и тепла, в отличие от металлов.
4. Химическая активность: Неметаллы проявляют более высокую химическую активность, чем металлы. Они образуют соединения с металлами и другими неметаллами. Примерами таких соединений являются соли, оксиды и галогены. Неметаллы также могут реагировать с водой и образовывать кислоты.
Вопрос-ответ

Какая разница между электроотрицательностью металлов и неметаллов?
Разница между электроотрицательностью металлов и неметаллов заключается в их способности притягивать электроны. Металлы обладают меньшей электроотрицательностью, поэтому они легче отдают электроны в химических реакциях. Неметаллы, напротив, имеют большую электроотрицательность и способны сильнее притягивать электроны, что делает их более реактивными и склонными к получению электронов.
Как связана электроотрицательность с химической активностью элементов?
Электроотрицательность напрямую связана с химической активностью элементов. Чем выше электроотрицательность элемента, тем больше его склонность к вступлению в химические реакции. Элементы с большой электроотрицательностью, такие как неметаллы, активно взаимодействуют с элементами с меньшей электроотрицательностью, например, металлами. Это связано с их способностью притягивать электроны и образовывать химические связи с другими элементами.
Какие элементы имеют самую высокую и самую низкую электроотрицательность?
Флуор имеет самую высокую электроотрицательность (4,0 по шкале Полинга), в то время как франций имеет самую низкую электроотрицательность (0,7 по шкале Полинга). Флуор является наиболее электроотрицательным элементом, так как он имеет самое сильное притяжение к электрону. Франций, с другой стороны, имеет самую низкую электроотрицательность, так как у него слабое притяжение к электрону, из-за большого размера его атома.
