2-ая группа периодической таблицы элементов включает в себя металлы, такие как бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Эти металлы обладают особыми свойствами и широко применяются в различных областях техники и науки.
Структура электронных уровней этих металлов обусловлена их положением в периодической системе и химическими свойствами. Они имеют общую конфигурацию электронных оболочек, которая помогает им образовывать химические связи и обладать металлическими свойствами.
На внешнем электронном уровне, 2-ой группы металлов имеют два электрона. Это делает их химически активными и позволяет им образовывать соединения с другими элементами. Они легко отдают эти два электрона, образуя положительные ионы. Благодаря этому, металлы 2-ой группы обладают свойством проводить тепло и электричество, а также хорошо тянуться и расплавляться.
Таким образом, структура электронных уровней у металлов 2 группы определяет их химические и физические свойства, делая их важными элементами в различных областях науки, техники и промышленности.
Смысл электронной структуры

Электронная структура металлов второй группы определяется расположением электронов на энергетических уровнях и отражает особенности поведения этих металлов в химических реакциях. Эта структура играет важную роль в формировании химических свойств и физических свойств металлов второй группы.
В электронной структуре металлов второй группы наибольшее значение имеют внешние электроны, которые находятся на последнем энергетическом уровне. Эти электроны обладают наибольшей энергией и определяют способность металлов к химическим реакциям.
Наличие свободных электронов в электронной структуре металлов второй группы обуславливает их способность проводить ток. Электроны могут свободно двигаться внутри металла, создавая электрический ток. В результате этого металлы второй группы обладают высокой электропроводностью и являются основными материалами для провода, контактов и других электронных устройств.
Электронная структура металлов второй группы также определяет их свойства в химических реакциях. Внешние электроны могут вступать в химические связи с другими элементами, образуя соединения. Однако, из-за наличия свободных электронов, металлы второй группы часто проявляют металлическое свойство - способность образовывать ионные связи с другими элементами.
Металлы 2 группы
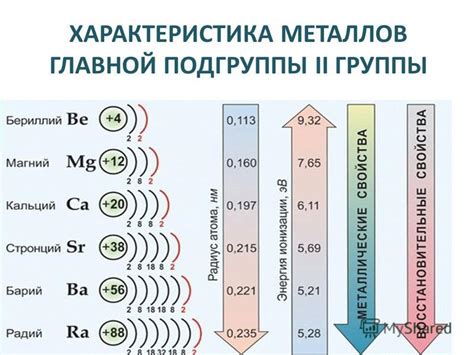
Металлы 2 группы – это химические элементы, которые относятся к группе 2 периодической системы Д.И. Менделеева. В эту группу входят металлы алкалиноземельные: бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Характерными свойствами данных металлов являются высокая электропроводность, хорошая теплопроводность и маленькое сопротивление. Они обладают блестящей поверхностью, что связано с их металлическим строением.
Электронная конфигурация внешней электронной оболочки металлов 2 группы представляет собой два электрона. Поэтому они имеют два валентных электрона и легко образуют ион положительного заряда. Эти металлы очень активны химически и реагируют с водой, кислородом и некоторыми другими веществами.
Летучесть металлов 2 группы возрастает от бериллия до радия. Бериллий мало реактивен и не растворяется в обычных кислотах, а радий обладает наибольшей реактивностью. Многие соединения этих металлов имеют яркий цвет, что позволяет использовать их в качестве красителей и пигментов в различных областях.
Особенности электронных уровней
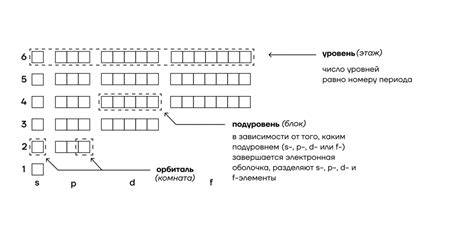
Электронные уровни металлов 2 группы характеризуются своими особенностями, влияющими на их химические и физические свойства.
Наиболее важной особенностью электронных уровней металлов 2 группы является наличие двух валентных электронов во внешней оболочке атома. Это делает металлы данной группы хорошими проводниками электричества и тепла. Валентные электроны находятся на s-орбитали и облегчают процесс ионизации, что обеспечивает высокую химическую активность металлов.
Также стоит отметить, что энергетические уровни d-подуровня заполняются после заполнения уровней s-подуровня. Это приводит к особому строению энергетической диаграммы электронов, называемой периодической системой элементов. На периодической таблице можно заметить периодическое изменение свойств элементов в одной группе, что связано с различными конфигурациями атомных энергетических уровней металлов 2 группы.
Кроме того, особенностью электронных уровней металлов 2 группы является их склонность образовывать соединения с элементами других групп. Например, они образуют ионные соединения с элементами 6 группы, обладающими 6 валентными электронами. Такие соединения обладают высокими точками плавления и кипения, что обусловлено наличием сильных электростатических связей между ионами.
Распределение электронов

Распределение электронов на электронных уровнях в металлах 2 группы имеет свои особенности. Начиная с первого электронного уровня, на котором находится всего один электрон, электроны распределены последовательно по энергетическим уровням в соответствии с принципом заполнения уровней.
Принцип заполнения уровней гласит, что каждый электронный уровень должен быть заполнен электронами с меньшей энергией перед тем, как заполниться электронами с более высокой энергией. Таким образом, на первом электронном уровне содержится 2 электрона, на втором электронном уровне - 8 электронов, на третьем электронном уровне - 18 электронов, и т.д.
Электроны на наружных электронных уровнях называют "валентными" электронами. В металлах 2 группы, таких как медь, цинк, никель и др., на самом внешнем электронном уровне находятся 1 или 2 валентных электрона. Это делает металлы 2 группы хорошими проводниками электричества и тепла, так как валентные электроны могут легко перемещаться между атомами.
Распределение электронов на электронных уровнях в металлах 2 группы определяет их химические и физические свойства. Свободные валентные электроны, особенно у металлов с одним валентным электроном, способствуют образованию металлических связей, которые придают металлам характерные свойства, такие как высокая теплопроводность и электропроводность.
Вопрос-ответ

Какова структура электронных уровней у металлов 2 группы?
Структура электронных уровней у металлов 2 группы состоит из двух внешних электронных уровней. На первом электронном уровне находится 2 электрона, а на втором - 8 электронов.
Какие металлы относятся к 2 группе?
К 2 группе относятся металлы: бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra).
Почему у металлов 2 группы 8 электронов на втором электронном уровне?
У металлов 2 группы 8 электронов на втором электронном уровне, потому что второй электронный уровень имеет максимальную вместимость в 8 электронов. Металлы 2 группы имеют 2 электрона на первом уровне, которые заполняют его полностью, и оставшиеся 8 электронов распределяются на втором уровне.
