Электронные конфигурации внешнего электронного слоя – это особые распределения электронов по энергетическим уровням в последней оболочке атома металла. Внешний электронный слой играет важную роль в определении химических свойств элемента, так как именно эти электроны участвуют в химических реакциях и образовании соединений.
Простые металлы часто имеют электронные конфигурации внешнего электронного слоя, которые можно представить в виде сферических слоев с постоянной энергией. Первые два электрона заполняют самый нижний энергетический уровень – s-орбиталь. Затем, следующие шесть электронов заполняют следующий энергетический уровень – p-орбиталь. Таким образом, первый период простых металлов имеет электронную конфигурацию s2p6.
Второй период простых металлов имеет электронную конфигурацию s2p6d10, так как дополнительные д-orbital энергетически более высокие и участвуют в заполнении внешнего электронного слоя. Третий период имеет электронную конфигурацию s2p6d10f14, и так далее, по мере заполнения следующих энергетических уровней.
Внешний электронный слой металлов: электронная конфигурация и особенности

Внешний электронный слой металлов играет важную роль в определении их химических и физических свойств. Этот слой состоит из электронов, находящихся на наибольшем энергетическом уровне в атоме металла. Знание электронной конфигурации внешнего слоя позволяет понять, как металлы взаимодействуют с другими элементами и осуществляют различные химические реакции.
Электронная конфигурация внешнего слоя металлов определяется их положением в периодической системе элементов. Обычно металлы находятся в левой части периодической системы, где у них на внешнем энергетическом уровне находится от 1 до 3 электронов. Из-за наличия нескольких электронов в этом слое, металлы обладают свойством образовывать ионные связи и легко отдавать свои электроны.
Особенность внешнего электронного слоя металлов заключается в том, что электроны в нём заполняют несколько подоболочек. Например, для металлов первой и второй групп периодической системы они заполняют s- и p-подоболочки. У металлов третьей группы заполняются s-, p- и d-подоболочки. А у металлов четвёртой и пятой групп заполняются все подоболочки, и электроны образуют заполненные s-, p-, d- и f-подоболочки.
Конфигурация внешнего электронного слоя влияет на химические свойства металлов. Например, элементы с одинаковым числом электронов в внешнем слое (группы) обладают схожими химическими свойствами. Внешние электроны металлов способны легко участвовать в химических реакциях, образуя ионные соединения с элементами, имеющими низкую электронную плотность, такими как неметаллы.
В целом, понимание электронной конфигурации внешнего электронного слоя металлов является важным для объяснения и предсказания его химических свойств, а также для изучения металлургических и физических свойств металлов.
Электронные уровни и внешний слой
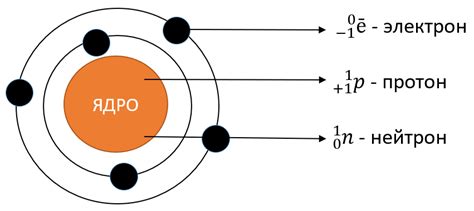
Электронные уровни - это энергетические уровни, на которых находятся электроны в атоме. Они распределены по энергии, от самых низких до самых высоких. Каждый электрон занимает определенный уровень в атоме.
Внешний слой - это самый высокий энергетический уровень, на котором находятся электроны в атоме. Он имеет особое значение, так как электроны на внешнем слое определяют химические свойства атома. Внешний слой также называется валентным слоем, именно электроны этого слоя участвуют в химических реакциях атома.
Электронные конфигурации металлов определяются количеством электронов на внешнем слое. Валентные электроны металлов могут легко участвовать в химических реакциях, образуя химические связи с другими атомами. Именно поэтому металлы обладают хорошей электропроводностью и металлическим блеском.
Электронные конфигурации металлов можно представить в виде электронной формулы, например, для железа Fe с атомным номером 26: 1s2 2s2 2p6 3s2 3p6 4s2 3d6. В этом случае, электроны на внешнем слое металла представлены электронами на 4s и 3d уровнях.
Зная электронные конфигурации металлов, можно предсказывать их химические свойства и реакционную активность. Например, металлы с полностью заполненными валентными слоями обладают малой химической активностью, в то время как металлы с неполностью заполненными валентными слоями могут образовывать химические связи с другими атомами и проявлять высокую реакционную активность.
Строение атома и орбитали
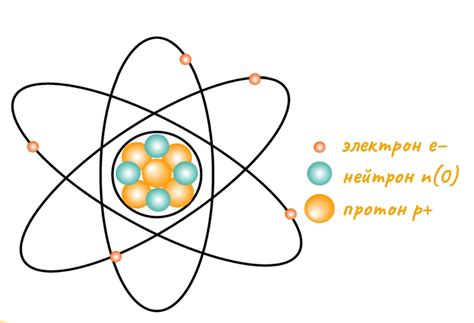
Строение атома – это пространственная организация частиц вокруг ядра. Основными компонентами атома являются ядро и электроны. В центре атома находится ядро, состоящее из протонов и нейтронов. Протоны обладают положительным зарядом, а нейтроны – не имеют заряда. Внешняя оболочка атома содержит электроны, которые обращаются по определенным орбитам.
Орбитали – это области пространства вокруг ядра, где могут находиться электроны. В зависимости от энергии электронов, орбитали различаются по форме и размерам. Существуют основные типы орбиталей: s-, p-, d- и f-орбитали. Каждая орбиталь может содержать определенное количество электронов.
S-орбитали имеют сферическую форму и могут содержать максимум 2 электрона. Эти орбитали ближе всего располагаются к ядру атома и имеют самую низкую энергию.
P-орбитали имеют двояковыпуклую форму, состоят из трех перпендикулярных плоскостей и могут содержать максимум 6 электронов. Орбитали этого типа имеют более высокую энергию, чем s-орбитали.
D-орбитали имеют форму двояковыпуклого диска и состоят из пяти перпендикулярных плоскостей. Они могут содержать максимум 10 электронов и обладают более высокой энергией, чем s- и p-орбитали.
F-орбитали имеют сложную форму и могут содержать максимум 14 электронов. Они обладают самой высокой энергией. D- и f-орбитали представляют орбитали внешнего электронного слоя валентности металлов, которые играют важную роль в их химических свойствах и реакциях.
Таким образом, строение атома и орбитали определяют распределение электронов в атоме и его химические свойства. Электронная конфигурация внешнего электронного слоя металлов имеет особую значимость во многих химических процессах и реакциях.
Октетное правило и его применение
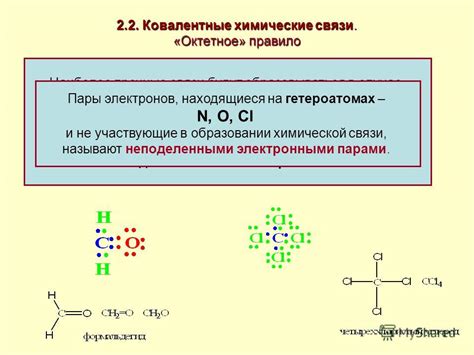
Октетное правило является одним из основных принципов в химии и описывает стремление атомов образовывать такие химические связи, которые позволяют им обретать электронную конфигурацию, аналогичную электронной конфигурации инертных газов. По октетному правилу, атом стремится заполнить свой внешний электронный слой восемью электронами.
Применение октетного правила находит важное применение при объяснении образования химических связей между атомами. Например, при образовании ионных соединений, атомы металлов отдают свои внешние электроны, чтобы образовать позитивно заряженные ионы, в то время как атомы неметаллов принимают эти электроны, образуя отрицательно заряженные ионы. Таким образом, оба типа атомов обретают октетную электронную конфигурацию и образуют ионные связи. К примеру, в соединении натрия с хлором (NaCl), атом натрия отдает свой внешний электрон, образуя позитивно заряженный ион Na+, а атом хлора принимает этот электрон, образуя отрицательно заряженный ион Cl-. Таким образом, оба атома достигают октетной электронной конфигурации.
Также октетное правило применяется при объяснении образования ковалентных связей, когда атомы неметаллов обмениваются парами электронов, чтобы образовать молекулы. К примеру, при образовании молекулы кислорода (O2), два атома кислорода обмениваются парами электронов, образуя две связи между ними. Каждый атом кислорода получает два электрона от другого атома, тем самым образуя две ковалентные связи. В результате оба атома кислорода достигают октетной электронной конфигурации.
Электронные конфигурации металлов

Электронные конфигурации внешнего электронного слоя металлов оказывают существенное влияние на их свойства и химическую активность. Внешний электронный слой металла определяется электронами на последней энергетической оболочке, также называемой валентной оболочкой.
Электронные конфигурации металлов могут быть различными, в зависимости от количества электронов на валентной оболочке и особенностей внутренней строения атомов. Например, железо имеет электронную конфигурацию [Ar]4s2 3d6, что означает, что на внешнем электронном слое находятся 2 электрона в s-орбитали и 4 электрона в d-орбиталях.
Электронные конфигурации металлов также определяют их возможности образования ионов. Например, через потерю внешнего s-электрона железо образует ион Fe2+, а через потерю внешних s- и d-электронов образует ион Fe3+. Ионы металлов с различными валентностями могут обладать различными химическими свойствами и способностью к реакциям с другими веществами.
Электронные конфигурации металлов могут быть представлены в виде периодической таблицы элементов. На периодической таблице электроны на внешнем слое представлены в отдельных группах с общими свойствами. Например, элементы с одинаковым количеством валентных электронов обычно обладают схожей химической активностью.
В целом, электронные конфигурации металлов являются одним из фундаментальных аспектов изучения их химических свойств и взаимодействий с другими веществами. Они позволяют предсказать реакционную способность и химическую активность металлов, а также определить их роль в различных физических и химических процессах.
D-блок и внешний электронный слой
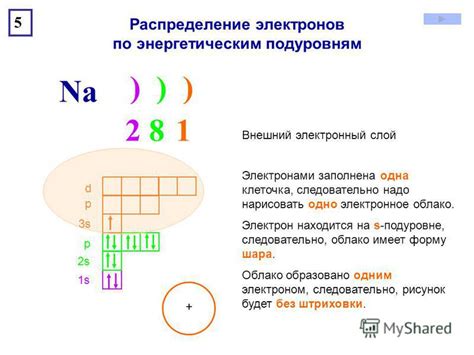
Металлы d-блока, также известные как переходные металлы, имеют особую особенность - наличие неполного внешнего электронного слоя. Внешний электронный слой переходных металлов заполняется d-электронами.
Процесс заполнения d-субоболочек происходит по правилу энергетического приоритета, по которому электроны помещаются в подуровни с более низкой энергией. Каждая d-субоболочка может вмещать от 1 до 10 электронов в зависимости от периода и группы элемента.
Внешний электронный слой переходных металлов обладает особыми свойствами, так как d-электроны могут участвовать в химических реакциях, формируя различные соединения и комплексы. При этом, д-электроны могут легко перемещаться между различными d-субоболочками, что делает переходные металлы хорошими проводниками электричества и тепла.
Кроме того, наличие неполного внешнего электронного слоя в переходных металлах указывает на их способность образовывать различные окислительные состояния. Это связано с возможностью перемещения электронов между различными d-субоболочками, что позволяет переходным металлам принимать разное количество электронов и образовывать соединения различной валентности.
Таким образом, внешний электронный слой переходных металлов играет важную роль в их химических свойствах, определяя их способность к реакциям, созданию соединений и образованию различных окислительных состояний.
Переходные металлы и их особенности

Переходные металлы – это элементы, находящиеся в середине таблицы периодических элементов. Они расположены между металлами с давно известной электронной конфигурацией и элементами с неполной электронной оболочкой. Переходные металлы обладают рядом уникальных особенностей, которые делают их важными и интересными для изучения.
Одной из основных особенностей переходных металлов является наличие у них внешнего электронного слоя, который не полностью заполнен электронами. Это позволяет переходным металлам образовывать ионные соединения с разными степенями окисления. Эти ионы имеют разную электронную конфигурацию, что влияет на их химические свойства.
Переходные металлы также обладают способностью к образованию комплексных соединений. Они могут образовывать стабильные соединения с другими веществами, в которых металл центрируется вокруг себя одного или нескольких лигандов. Это позволяет переходным металлам проявлять разнообразие химических реакций и обладать широким спектром свойств.
Еще одной особенностью переходных металлов является их способность образовывать специфические каталитические системы. Благодаря наличию постоянно меняющихся степеней окисления и активных центров, переходные металлы могут участвовать в химических реакциях в качестве катализаторов. Они способны ускорять реакции, снижать энергию активации и повышать выборочность процессов.
В итоге можно сказать, что переходные металлы отличаются от других элементов периодической системы своими уникальными свойствами. Их способность к образованию ионных соединений с разными степенями окисления, образованию комплексных соединений и участию в каталитических реакциях делает их важными элементами для разных областей науки и промышленности.
Положение металлов в периодической таблице

Металлы – это класс элементов в периодической таблице, обладающих характеристиками, такими как хорошая электропроводность и теплопроводность, гибкость, отличные механические свойства и способность образовывать ионные соединения соответствующих положительно заряженных ионов. Они преобладают в левой части таблицы, начиная с группы 1 (щелочные металлы) и заканчивая группой 13 (бор).
Металлы занимают большую часть периодической таблицы из-за особенностей их электронной конфигурации. У каждого металла на внешнем электронном слое находится 1 или 2 электрона, что делает их хорошими отдатчиками электронов при образовании химических связей.
В процессе образования ионов металлы, как правило, отдают электроны, их электронное строение превращается в электронное строение инертного газа. Например, натрий (Na), находящийся в первой группе, отдает один электрон и превращается в ион Na+, у которого теперь электронная конфигурация аналогична конфигурации неона (Ne).
В периодической таблице металлы классифицируются как легкие металлы, йодороды, щелочные металлы, щелочноземельные металлы, побочные металлы, переходные металлы, платина, благородные металлы, нестандартные металлы и концентрированные металлы. Каждый из этих классов имеет свои уникальные электронные и химические свойства, которые определяют их положение в периодической таблице и их возможности во взаимодействии с другими элементами.
Влияние внешнего электронного слоя на свойства металлов

Электронный слой внешней оболочки атома металла является ответственным за многие физические и химические свойства этого элемента. Способность металлов образовывать проводимую решетку и обладать высокой теплопроводностью и электропроводностью обусловлена наличием свободных электронов во внешнем электронном слое. Они отвечают за передачу энергии и электричества между атомами металла и обуславливают его металлические свойства.
Кроме того, электроны в внешнем слое металла играют важную роль в химических реакциях. Они определяют активность металла, его способность образовывать соединения с другими элементами. Если внешний электронный слой металла полностью заполнен, то он будет иметь малую активность и не будет легко реагировать с другими веществами. Напротив, если слой неполностью заполнен, металл будет активен и сможет легко образовывать соединения с другими элементами.
Свойства металлов также зависят от положения элемента в таблице химических элементов. Например, элементы в одной вертикали таблицы, такие как литий, натрий и калий, имеют похожие свойства из-за того, что их внешний электронный слой содержит один электрон. Это делает их химически активными и способными образовывать легкорастворимые соединения с другими элементами.
Таким образом, внешний электронный слой играет важную роль в определении свойств металлов. Электроны этого слоя отвечают за металлические свойства металлов и их активность в химических реакциях. Знание электронных конфигураций внешнего слоя металлов позволяет предсказывать и понимать их физические и химические свойства.
Вопрос-ответ

Какова роль внешнего электронного слоя металлов?
Внешний электронный слой металлов играет важную роль в их свойствах и реактивности. Он определяет возможность образования связей с другими элементами и влияет на проводимость электричества и тепла металлов.
Каковы особенности электронных конфигураций внешнего электронного слоя у металлов?
Особенностью электронных конфигураций внешнего электронного слоя у металлов является наличие неполной оболочки. Обычно такие металлы имеют один или несколько валентных электронов в своем внешнем слое, что делает их реактивными и способными образовывать соединения с другими элементами.
