Металлы побочных подгрупп являются важным классом химических элементов и играют ключевую роль в различных отраслях промышленности. Они характеризуются своей уникальной электронной структурой, которая определяет их химические и физические свойства.
В электронных формулах металлов побочных подгрупп используются символы, которые представляют химические элементы и указывают на количество и расположение электронов в их атомах. Каждый атом металла побочной подгруппы имеет определенное количество электронов в своих энергетических оболочках, которые образуют электронную формулу.
Например, электронная формула железа (Fe) выглядит следующим образом: 1s2 2s2 2p6 3s2 3p6 4s2 3d6. Это означает, что в атоме железа на первом энергетическом уровне находятся 2 электрона, на втором - 8 электронов, на третьем - 14 электронов, а на четвертом - 6 электронов.
Электронные формулы металлов побочных подгрупп помогают понять, какие электроны участвуют в химических реакциях и связывании с другими элементами. Они также позволяют предсказать химические свойства металлов и объяснить их реакционную способность и способность образовывать соединения с другими элементами.
Сущность электронных формул металлов побочных подгрупп
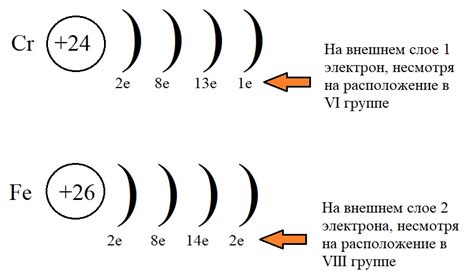
Электронные формулы металлов побочных подгрупп являются инструментом, который используется для представления распределения электронов во внешней оболочке атомов этих металлов. В этих формулах отображается количество электронов в каждом энергетическом уровне, а также их режимы заполнения.
Ключевым элементом электронных формул металлов побочных подгрупп являются энергетические уровни, на которых располагаются электроны. Эти уровни аккуратно рассортированы в порядке возрастания энергии. При заполнении электронами, уровни заполняются по очереди, начиная с самого низшего.
Одно из ключевых понятий в электронных формулах металлов побочных подгрупп - это орбитали. Орбитали представляют собой место, где может находиться электрон. Каждая орбиталь может вмещать определенное количество электронов, в зависимости от их типа.
В электронных формулах металлов побочных подгрупп электроны обозначаются с помощью стрелок, которые указывают на направление спина электрона. Стрелки, направленные вверх, обозначают электроны со спином вверх, а стрелки, направленные вниз, обозначают электроны со спином вниз.
Электронные формулы металлов побочных подгрупп предоставляют информацию о строении атомов этих металлов и позволяют изучать их свойства и способность образовывать химические связи. Это важный инструмент в химических исследованиях и позволяет углубить понимание химической природы этих металлов.
Роль электронной структуры металлов побочных подгрупп

Электронная структура металлов побочных подгрупп играет важную роль в их химических и физических свойствах. Металлы побочных подгрупп, такие как кобальт, никель или цинк, имеют общую особенность - наличие нескольких незаполненных подуров энергетической оболочки. Это делает их активными взаимодействующими элементами, способными образовывать соединения с другими элементами и ионами.
Свободные электроны в металлах побочных подгруппах обладают высокой подвижностью. Они могут переходить с одного атома на другой, что обеспечивает проводимость электричества и тепла у данных металлов. Благодаря этому металлы побочных подгрупп нашли широкое применение в электротехнике и металлургии.
Электронная структура металлов побочных подгрупп также влияет на их химическую активность. Благодаря наличию незаполненных подуров, эти металлы обладают способностью к образованию различных ионов и соединений. Например, никель может образовывать ионы Ni2+ и соединения с различными анионами, такими как кислород, сера или гидроксидные ионы.
Значительная часть примеси металлов побочных подгрупп влияет на их свойства и химическую активность. Например, добавление некоторых легирующих элементов может изменить электронную структуру металла и его механические свойства. Также легирование позволяет получить сплавы с новыми свойствами, которые могут быть уникальными для определенных отраслей промышленности.
Свойства электронной структуры металлов побочных подгрупп
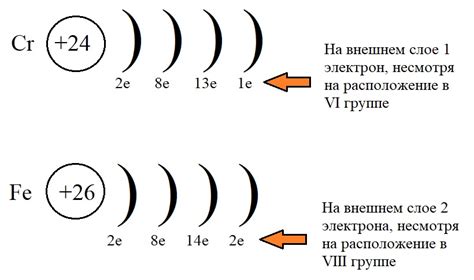
Металлы побочных подгрупп – это элементы с химическими свойствами, подобными металлам, но которые располагаются в таблице Менделеева между основными металлами и неметаллами. Они включают элементы бора, кремния, германия, мышьяка, сурьмы, теллура, полония и астат, и обладают рядом уникальных свойств.
Одним из ключевых свойств металлов побочных подгрупп является их электронная структура. Атомы этих элементов характеризуются нарушением правил аддитивности квантовых чисел. Вместо принятого порядка электронного заполнения оболочек, металлы побочных подгрупп имеют сложные электронные конфигурации, включающие различные уровни энергии и подуровни.
Особенности электронной структуры металлов побочных подгрупп имеют важное значение для их физических и химических свойств. Наличие заполненных слоев и подуровней с высокой энергией позволяет им образовывать стабильные соединения с другими элементами и проявлять металлическую проводимость.
Большинство металлов побочных подгрупп имеют высокие температуры плавления и кипения, что связано с наличием сложных электронных структур. Кроме того, они обладают хорошей теплопроводностью и электропроводностью. Электроны, находящиеся в высокоэнергетических уровнях, легко перемещаются по структуре металла, образуя электронное облако, которое обеспечивает его металлические свойства.
Электронная структура металлов побочных подгрупп также определяет их химическую реактивность. Взаимодействие электронных облаков с другими атомами позволяет им образовывать стабильные химические связи и образовывать соединения с широким спектром свойств. Некоторые элементы металлов побочных подгрупп, например, германий и кремний, являются полупроводниками и широко используются в электронной промышленности.
Вопрос-ответ

Какие металлы относятся к побочным подгруппам?
К побочным подгруппам относятся такие металлы, как цинк, кадмий, ртуть, алюминий, свинец, титан, медь и др.
Какая электронная формула у металла цинк?
У металла цинк электронная формула: [Ar] 3d10 4s2.
Какие свойства обладает металл ртуть?
Металл ртуть обладает следующими свойствами: жидкий при комнатной температуре, высокая плотность, высокая электропроводность.
