Атомы щелочных металлов, таких как литий, натрий, калий, рубидий и цезий, являются особенными в мире химии и физики. Их электронное строение и внешний энергетический уровень определяют множество их уникальных свойств и реакций.
Электронное строение атомов щелочных металлов характеризуется наличием одного или двух электронов на внешней энергетической оболочке. Эти электроны, называемые валентными, имеют ключевое значение в химических реакциях этих металлов. Благодаря наличию одного или двух валентных электронов, атомы щелочных металлов имеют склонность к терять эти электроны и образовывать положительные ионы.
Внешний энергетический уровень атомов щелочных металлов является самым высокоэнергетическим уровнем электронной оболочки. Именно на нем располагаются валентные электроны, определяющие взаимодействие атомов с другими веществами. Взаимодействие атомов щелочных металлов с другими атомами и молекулами происходит путем передачи или принятия электронов, что влияет на их активность и реакционную способность.
Атомы щелочных металлов имеют сильное стремление к стабилизации своего электронного строения, поэтому они легко вступают в реакции с другими веществами, образуя соли и прочие соединения.
Понимание электронного строения и внешнего энергетического уровня атомов щелочных металлов является необходимым для объяснения их свойств и способности взаимодействовать с окружающей средой. Изучение этих характеристик помогает химикам и физикам понять реакционные механизмы и разрабатывать новые материалы и технологии на основе щелочных металлов.
Электронные оболочки атомов щелочных металлов

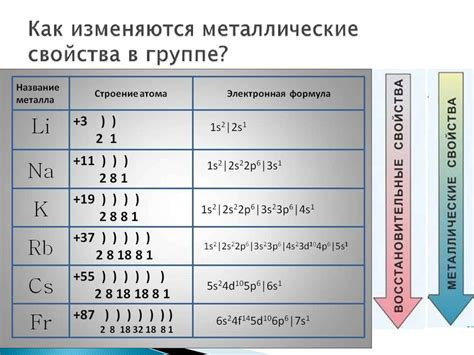
Щелочные металлы являются элементами первой группы периодической таблицы. Они включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). У атомов щелочных металлов особенно интересны их электронные оболочки, так как они обладают одной электронной оболочкой с одной электронной подоболочкой s.
Каждый атом щелочного металла имеет в своей электронной оболочке одну валентную электрон, который находится на внешнем s-орбитале. Такая конфигурация оболочки делает атомы щелочных металлов очень реактивными и способными легко отдавать этот валентный электрон для образования ионов положительного заряда.
Например, литий имеет электронную конфигурацию 1s2 2s1, что означает, что у него один валентный электрон на внешней s-орбитале. Этот валентный электрон может быть легко отдан, чтобы образовать ион Li+ с положительным зарядом.
Также интересно, что жизненная активность щелочных металлов возрастает при движении вниз по группе. Это происходит из-за увеличения размера атомов и уменьшения силы притяжения ядра к валентным электронам. Это делает электрон еще более легким для отдачи и увеличивает химические свойства металлов.
Конфигурация электронной оболочки внешнего энергетического уровня

Электронная оболочка атома щелочного металла состоит из энергетических уровней, на которых располагаются электроны. Внешний энергетический уровень является самым высоким и содержит в себе последний электрон. Конфигурация этого уровня определяет химические свойства атома и его взаимодействие с другими атомами.
Внешний энергетический уровень щелочных металлов содержит один или два электрона. Например, у атома лития (Li) внешний энергетический уровень содержит один электрон с конфигурацией 2s1. У атома натрия (Na) внешний энергетический уровень также содержит один электрон, но его конфигурация уже 3s1.
Электроны на внешнем энергетическом уровне играют важную роль в химических реакциях атомов щелочных металлов. Именно они вступают во взаимодействие с электронами других атомов, образуя химические связи и стабилизируя молекулы и соединения. Благодаря наличию одного электрона на внешнем энергетическом уровне, которому недостает всего одного электрона для заполнения, атомы щелочных металлов с легкостью отдают этот электрон и образуют стабильные ионные соединения.
Валентность атомов щелочных металлов

Валентность — это электрохимическая характеристика атома, которая показывает сколько электронов атом способен отдать или принять при взаимодействии с другими атомами. Валентность атома щелочных металлов является ключевым аспектом их химической активности.
Атомы щелочных металлов, таких как литий, натрий, калий и др., имеют наружную энергетическую оболочку, состоящую из одного электрона. Этот электрон легко отдают и образуют положительные ионы с валентностью +1. Такая валентность обусловлена тем, что атому достаточно отдать один электрон, чтобы достичь электронной конфигурации предыдущего инертного газа.
Валентность атома щелочных металлов также может быть определена по периодической системе элементов. Щелочные металлы находятся в первой группе, и их атомы имеют одну наружную энергетическую оболочку. Это означает, что их валентность всегда будет +1. Она не может быть больше или меньше, так как атомы щелочных металлов стремятся достичь стабильной электронной конфигурации ионов инертных газов.
Именно благодаря своей валентности и способности легко отдавать один электрон, атомы щелочных металлов проявляют свою химическую активность и имеют множество практических применений. Например, они используются в процессах горения, для получения энергии в батареях, а также в различных химических реакциях и процессах синтеза веществ.
Взаимодействие атомов щелочных металлов с другими химическими элементами
Атомы щелочных металлов, такие как литий, натрий, калий, рубидий и цезий, имеют одиночный внешний энергетический уровень с одним электроном, легко вступают в реакции с другими элементами. Они обладают сильными основными свойствами и реагируют с водой, кислородом и галогенами. Взаимодействие атомов щелочных металлов с другими элементами происходит за счет передачи или приема электронов.
Вода, как хороший растворитель, способствует разрыву межатомных связей в щелочных металлах, что приводит к образованию гидроксидов щелочных металлов и выделению водорода. Эти реакции являются экзотермическими, то есть сопровождаются выделением тепла. Некоторые щелочные металлы, такие как литий или калий, реагируют с водой незначительно, в то время как натрий или цезий реагируют намного активнее.
Щелочные металлы также реагируют с кислородом, образуя оксиды щелочных металлов. Эти оксиды являются основаниями и обладают свойством растворяться в воде, образуя гидроксиды. В реакциях с галогенами, атомы щелочных металлов образуют ионные соединения, такие как хлориды, бромиды и йодиды щелочных металлов. Эти соединения обладают высокой степенью растворимости и хорошей электропроводностью.
Вопрос-ответ

Что такое атомы щелочных металлов?
Атомы щелочных металлов - это атомы элементов первой группы периодической системы Менделеева, включающей литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Щелочные металлы характеризуются высокой реакционной способностью и образованием ионов с положительным зарядом.
Почему атомы щелочных металлов имеют один валентный электрон на внешнем энергетическом уровне?
Атомы щелочных металлов имеют один валентный электрон на внешнем энергетическом уровне из-за особенностей их электронной конфигурации. Все атомы щелочных металлов имеют электронную конфигурацию, заканчивающуюся на ns1, где n - номер энергетического уровня. Такая конфигурация означает, что внешний энергетический уровень содержит только один электрон, который является валентным. Именно этот электрон отвечает за химические свойства атома щелочного металла.
