Переходные металлы являются основными элементами периодической таблицы, расположенными между металлами с алионами и металлоидами. Они обладают уникальными свойствами, включая способность образовывать комплексы с различными лигандами. Электронное строение комплексов переходных металлов определяет их химические и физические свойства.
Комплексы переходных металлов состоят из центрального атома переходного металла, окруженного лигандами. Лиганды могут быть аниоными, нейтральными молекулами или катионами. Центральный атом переходного металла обладает неполной оболочкой d-электронов, что позволяет ему вступать в химические реакции и образовывать стабильные комплексы.
Электронное строение комплексов переходных металлов описывается с помощью теории кристаллического поля и теории органического поля. Теория кристаллического поля объясняет влияние лигандов на энергетические уровни d-орбиталей переходных металлов и разделяет их на две группы: t2g (нижние трех) и eg (верхние две).
Основные свойства комплексов переходных металлов включают переменность валентности, наличие магнитных свойств, высокую активность как катализаторы и возможность образования различных изомеров и стереоизомерных форм. Изучение электронного строения комплексов переходных металлов является важным для понимания их свойств и развития новых материалов и технологий.
Строение комплексов переходных металлов

Комплексы переходных металлов представляют собой соединения, включающие в себя переходные металлы и один или несколько лигандов. Лиганды могут быть атомами, ионами или молекулами, которые образуют координационную связь с металлическим ионом. Одним из главных принципов строения комплексов переходных металлов является окружение металлического иона лигандами. Оно определяет пространственную структуру комплекса и его физико-химические свойства.
Комплексы переходных металлов часто образуют различные типы окружения металлического иона. Одним из наиболее распространенных типов окружения является октаэдрическое, где металлический ион окружен восемью лигандами в форме призмы. Другие типы окружения включают квадратно-плоский, тетраэдрический и октаэдрический ионы и др.
Строение комплексов переходных металлов зависит от вида и количества лигандов, а также от электронной конфигурации самого металлического иона. Комплексы с различными лигандами могут образовывать различные геометрические и структурные формы. Это позволяет комплексам обладать различными свойствами и активностью, включая катализаторы, магнитные свойства, оптические свойства и другие.
Важно отметить, что электронное строение комплексов переходных металлов также играет важную роль в их свойствах. Электронная конфигурация металлического иона определяет его способность образовывать координационные связи и взаимодействовать с лигандами. Отличия в электронной конфигурации могут приводить к различиям в спектрах поглощения и рассеяния света, магнитных свойствах и других свойствах комплексов.
Определение и классификация
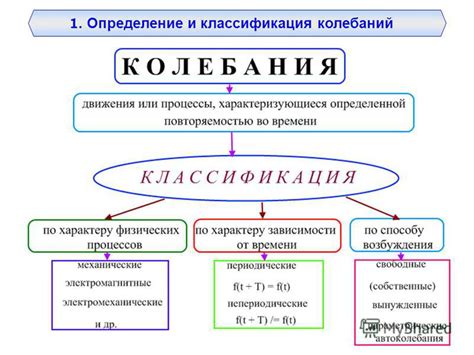
Электронное строение комплексов переходных металлов - это распределение электронов по энергетическим уровням и оболочкам в атомах или ионах переходных металлов, а также их взаимодействие с лигандами.
Переходные металлы обладают внутренней d-электронной оболочкой, которая представляет собой основу для формирования комплексов. Электронное строение комплексов определяется количеством электронов в d-оболочке, а также типами и расположением лигандов.
Классификация комплексов переходных металлов может быть осуществлена по различным признакам. Одним из основных критериев является валентность металла - число электронов в d-оболочке. В зависимости от валентности можно выделить комплексы однозарядных (валентность +1) и многозарядных (валентности от +2 до +7). Кроме того, комплексы могут быть классифицированы по типу лигандов, взаимодействию с растворителем, а также по типу связей между металлом и лигандами.
Таким образом, электронное строение комплексов переходных металлов является ключевым фактором, определяющим их свойства и реакционную способность. Классификация комплексов по валентности металла и типу лигандов позволяет систематизировать и изучать их структуру и функции в различных химических процессах.
Электронное строение комплексов
Электронное строение комплексов переходных металлов играет важную роль в их химической и физической активности. Комплексы состоят из центрального атома или иона переходного металла, окруженного лигандами, которые могут быть различных типов: нейтральными, заряженными или анионами. Лиганды влияют на электронную структуру и свойства комплекса.
Основными принципами определения электронной структуры комплексов являются правила Хунда и правила аномального ЭЦЭ. Правило Хунда устанавливает, что электроны размещаются в подуровнях с одинаковым энергетическим уровнем, заполняя их в отдельных состояниях с наименьшей энергией. Правило аномального ЭЦЭ говорит о том, что при наличии возможности двух или более состояний с одинаковой энергией, электроны заполняют энергетически менее выгодные состояния в результате сильного взаимодействия внутриатомных и межатомных электронов.
Электронное строение комплексов переходных металлов может быть описано с помощью диаграмм Молекулярных орбиталей (МО). Проведение MO-диаграммы позволяет определить, какие орбитали переходного металла участвуют в образовании связи с лигандами и какова будет полная электронная конфигурация комплекса. Для описания электронного строения комплексов используется нотация типа d^n, где n - количество электронов в d-подобной орбитали переходного металла.
Основные принципы образования комплексов

Образование комплексов переходных металлов основано на нескольких основных принципах. Для начала, переходные металлы в своем внешнем электронном строении имеют неполный д или f-субуровни, что делает их особенно реакционными. Это связано с тем, что за счет наличия непарных электронов на этих подуровнях они могут образовывать связи с другими атомами или ионами и формировать комплексы.
Второй принцип заключается в том, что переходные металлы могут образовывать комплексы с множеством различных лигандов. Лиганды - это атомы, ионы или молекулы, которые образуют координационную связь с металлом при образовании комплекса. Лиганды могут быть однозарядными или многозарядными, что влияет на зарядность комплекса.
Третий принцип образования комплексов состоит в возможности образования различных структурных типов. Комплексы могут иметь линейную, планарную или октаэдрическую геометрию в пространстве, в зависимости от числа и типа лигандов. Данное свойство определяется способностью переходных металлов формировать соединения с различным числом координационных связей.
Кроме того, формирование комплексов сопровождается изменением электронного строения переходного металла. Обычно при образовании комплекса происходит перераспределение электронов, что может приводить к изменению парамагнитных свойств вещества и его спектральных характеристик.
Таким образом, основными принципами образования комплексов переходных металлов являются наличие неполных d или f-субуровней, возможность образования комплексов с различными лигандами, разнообразие структурных типов и изменение электронного строения металла при образовании комплекса.
Свойства переходных металлов

1. Ионизационная энергия: Переходные металлы обладают высокой ионизационной энергией, что свидетельствует о трудности отрыва электрона от атома. Это объясняет их способность образовывать ионы с различными степенями окисления.
2. Твердость и прочность: Переходные металлы часто обладают высокой твердостью и прочностью. Их кристаллическая структура позволяет им формировать сильные связи между атомами, что делает их прочными материалами.
3. Магнитные свойства: Некоторые переходные металлы обладают магнитными свойствами, такими как ферромагнетизм, антиферромагнетизм или парамагнетизм. Эти свойства связаны с ориентацией магнитных моментов атомов в кристаллической решетке.
4. Электрическая проводимость: Многие переходные металлы являются хорошими проводниками электричества. Они обладают большим количеством свободных электронов в своей электронной структуре, что обеспечивает высокую электрическую проводимость.
5. Каталитическая активность: Переходные металлы часто выступают в роли катализаторов, ускоряя химические реакции. Они способны участвовать в различных каталитических процессах, благодаря своей способности изменять степень окисления и образовывать комплексы с молекулами реагентов.
6. Реактивность и образование соединений: Переходные металлы имеют разнообразные степени окисления и могут образовывать различные соединения с другими элементами. Они способны образовывать комплексы с анионами, молекулами органических соединений и другими металлами, что обуславливает их широкую реактивность и способность к образованию различных соединений.
Влияние электронного строения на свойства комплексов
Электронное строение является основным фактором, определяющим свойства комплексов переходных металлов. Количество электронов во внешней оболочке переходного металла влияет на их химическую активность и соединительные свойства. Наличие свободных d-орбиталей в атоме переходного металла позволяет ему формировать комплексы с лигандами, образуя координационные связи.
Изменение электронного строения комплексов переходных металлов может приводить к изменению их физических и химических свойств. Например, изменение числа электронов в d-орбитали может привести к изменению спектральных характеристик комплексов, таких как цвет, интенсивность и положение поглощения или испускания света.
Электронное строение также влияет на возможность комплекса быть окислителем или восстановителем в реакциях. Комплексы с большим количеством несовпадающих позитивных и негативных зарядов могут легко участвовать в окислительно-восстановительных реакциях.
Более сложные комплексы с большим числом лигандов могут образовывать внутримолекулярные связи, что может привести к изменению конформации молекулы и ее реакционной активности. Электронное строение также влияет на стабильность комплексов и их растворимость в различных средах.
Вопрос-ответ

Какие основные принципы определяют электронное строение комплексов переходных металлов?
Основные принципы, определяющие электронное строение комплексов переходных металлов, включают условие электронейтральности, правило 18-и электронов, правило сопряжения, правило Хандраника, а также правило Хунта.
Что означает условие электронейтральности в электронном строении комплексов переходных металлов?
Условие электронейтральности гласит, что сумма зарядов комплекса и его лигандов должна быть равна нулю. Это означает, что в комплексе должно быть столько электронов, сколько зарядов на комплексную часть.
Какие свойства определяют электронное строение комплексов переходных металлов?
Электронное строение комплексов переходных металлов определяет их способность к образованию связей с лигандами, а также их магнитные свойства, цветность и активность в реакциях.
