Щелочные металлы - это элементы первой группы периодической системы, включающие литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Одной из ключевых характеристик атомов этих элементов является их электронная конфигурация. Электронная конфигурация определяет расположение электронов в атоме и может оказывать значительное влияние на химические свойства щелочных металлов.
В атоме каждого щелочного металла существует несколько энергетических уровней, на которых располагаются электроны. Однако наиболее важным является последний, внешний энергетический уровень. Именно электроны на внешнем уровне определяют химические свойства атома. Вещества щелочных металлов, обладающие всего одним электроном на внешнем уровне, имеют большую склонность к реакциям, так как они стремятся избавиться от этого электрона и образовать ион с положительным зарядом.
Электронная конфигурация атомов щелочных металлов может быть представлена в виде логической последовательности заполнения энергетических уровней электронами. Например, электронная конфигурация лития: 1s^2 2s^1. Здесь "1s^2" означает, что на первом энергетическом уровне находятся 2 электрона, а "2s^1" указывает на 1 электрон на втором энергетическом уровне. Благодаря простой структуре электронной конфигурации, атомы щелочных металлов проявляют сходные химические свойства и великолепно реагируют с другими элементами, образуя стабильные химические соединения.
Электронная конфигурация атомов щелочных металлов

Электронная конфигурация атомов щелочных металлов определяет их химические и физические свойства. Щелочные металлы состоят из одного электрона на внешнем энергетическом уровне, что делает их крайне реактивными.
Наиболее известными представителями щелочных металлов являются литий (Li), натрий (Na), калий (K), рубидий (Rb) и цезий (Cs). Все эти элементы относятся к первой группе периодической системы.
У атомов щелочных металлов электронная конфигурация начинается с полностью заполненного внутреннего энергетического уровня, а затем идет один электрон на внешний s-подуровень. Например, электронная конфигурация лития составляет 1s^2 2s^1, где 1s^2 обозначает заполненный внутренний уровень, а 2s^1 - один электрон на внешнем s-подуровне.
Такая электронная конфигурация делает атомы щелочных металлов нестабильными, так как они стремятся заполнить свой внешний энергетический уровень путем отдачи своего единственного электрона. Это приводит к тому, что щелочные металлы легко реагируют с другими элементами, образуя ионные связи.
Электронная конфигурация атомов щелочных металлов также влияет на их физические свойства. Например, они обладают низкой плотностью, низкой температурой плавления и кипения, а также хорошей электропроводностью.
Энергетический уровень атомов щелочных металлов

Энергетический уровень атомов щелочных металлов является ключевым параметром, определяющим их химические и физические свойства. Он определяет расположение электронов в атоме и обуславливает их взаимодействие с другими атомами и молекулами.
Атомы щелочных металлов, таких как литий (Li), натрий (Na), калий (K) и др., имеют всего одну электронную оболочку с одним валентным электроном. Этот электрон находится на наиболее удаленном от ядра энергетическом уровне, так называемом внешнем уровне. Он обладает наименьшей энергией и наибольшей подвижностью среди всех электронов в атоме.
Электронный конфигурация атомов щелочных металлов следующая: 2 электрона на s-подуровне первой энергетической оболочки (Li - 1s2, Na - 1s22s22p63s1, K - 1s22s22p63s23p64s1 и т.д.).
Энергетический уровень внешнего электрона определяет его скорость реакции с другими атомами и молекулами. Благодаря высокой подвижности валентного электрона, атомы щелочных металлов легко образуют ионы, взаимодействуют с водой, газами и другими веществами, образуя различные соединения.
Кроме того, внешний энергетический уровень атомов щелочных металлов определяет их металлические свойства, такие как проводимость электричества и тепла. Валентный электрон в атоме щелочных металлов свободно перемещается по энергетическим уровням, образуя "электронное облако". Это облако электронов создает положительный ионный катион, который взаимодействует с другими атомами и молекулами вещества.
Взаимодействие внешнего энергетического уровня
Внешний энергетический уровень атома щелочного металла является ключевым элементом, определяющим его химические свойства и реакционную способность. Этот уровень представляет собой последний энергетический уровень, на котором находятся электроны в атоме.
Взаимодействие внешнего энергетического уровня с другими атомами или молекулами определяет способность щелочных металлов образовывать соединения и участвовать в химических реакциях. Щелочные металлы, такие как литий, натрий, калий и др., имеют один электрон на внешнем энергетическом уровне, что делает их очень реакционноспособными элементами.
Электроны на внешнем энергетическом уровне щелочных металлов легко отдаются или принимаются, что позволяет им образовывать ионные соединения с другими элементами. Например, натрий может отдать свой электрон другому элементу, образуя положительно заряженный ион Na+, а кислород может принять этот электрон, образуя отрицательно заряженный ион O-. Это взаимодействие внешнего энергетического уровня позволяет щелочным металлам участвовать в множестве химических реакций, включая образование солей, взаимодействие с водой и т.д.
Кроме того, внешний энергетический уровень щелочных металлов также влияет на их физические свойства, такие как плавкость, температура плавления и кипения. Низкое количество электронов на внешнем энергетическом уровне позволяет атомам щелочных металлов легко передвигаться и заполнять свои подэнергетические уровни. Это является одной из причин, почему щелочные металлы имеют низкую температуру плавления и кипения.
Реактивность щелочных металлов
Реактивность щелочных металлов определяется их электронной конфигурацией и внешним энергетическим уровнем. Щелочные металлы имеют одну электрону на самом внешнем энергетическом уровне, что делает их очень реактивными и легко реагирующими с другими элементами.
При реакциях щелочных металлов обычно происходит потеря электрона, образуя положительный ион. Это связано с тем, что даже один электрон на внешнем энергетическом уровне занимает много энергии и довольно легко может быть оторван от атома. В результате этого электронного перехода они образуют ионы с положительным зарядом, которые находятся в постоянном поиске электронов для компенсации своего заряда.
Имея высокую реактивность, щелочные металлы реагируют с различными веществами, включая воду, кислород, воздух, галогены и многие другие элементы. При контакте с водой они быстро реагируют, образуя щелочные растворы и выделяя водород. Также, при воздействии на воздух, они окисляются и образуют оксиды.
Важно отметить, что реактивность щелочных металлов возрастает при движении от верхнего к нижнему краю группы периодической системы. Это объясняется увеличением размера атома и слабой силой удерживаемых электронов, что усиливает их способность к отдаче электрона и реактивности.
Влияние энергетического уровня на физические свойства

Энергетический уровень атомов щелочных металлов влияет на их физические свойства, определяя их структуру, состояние и реактивность. Энергетический уровень внешней оболочки атома определяет его химические связи с другими атомами, а также электронные и магнитные свойства.
Атомы щелочных металлов имеют одну электронную оболочку, состоящую из одного энергетического уровня - s-уровня. Этот энергетический уровень имеет низкую энергию, что делает атомы щелочных металлов очень реактивными и легко реагирующими с другими веществами.
Внешний энергетический уровень атомов щелочных металлов определяет их химическую активность и способность образовывать ионы. Именно благодаря наличию одного электрона в внешнем s-уровне атомы щелочных металлов образуют положительные ионы, легко отдающие свой электрон. Таким образом, они образуют сильные щелочные растворы и являются мощными окислителями.
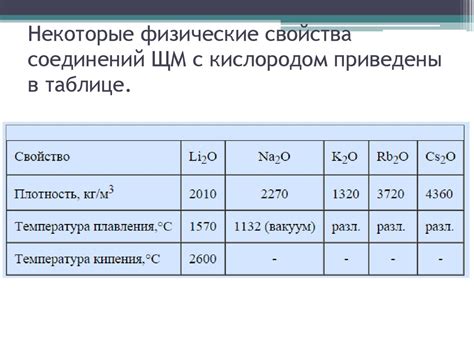
Физические свойства щелочных металлов также связаны с их энергетическим уровнем. Низкая энергия s-уровня делает атомы щелочных металлов мягкими и хорошо деформируемыми. Они обладают низкой плотностью и низкой температурой плавления и кипения. Кроме того, атомы щелочных металлов имеют высокую электропроводность благодаря своей электронной структуре.
Таким образом, энергетический уровень атомов щелочных металлов играет важную роль в их химических и физических свойствах. Он определяет их реактивность, способность образовывать ионы и их физические характеристики, такие как мягкость и температура плавления. Понимание этих свойств помогает в изучении и применении щелочных металлов в различных областях науки и техники.
Вопрос-ответ

Каковы особенности электронной конфигурации атомов щелочных металлов?
Особенностью электронной конфигурации атомов щелочных металлов является наличие одного валентного электрона на внешнем энергетическом уровне. Это делает их очень реакционноспособными и склонными образовывать ионы с однократным положительным зарядом.
Как внешний энергетический уровень влияет на свойства атомов щелочных металлов?
Внешний энергетический уровень определяет химические свойства атомов щелочных металлов. Благодаря наличию одного валентного электрона на этом уровне, щелочные металлы имеют способность активно реагировать с другими веществами, образуя ионы с положительным зарядом и обеспечивая таким образом их высокую реакционность.
Какие свойства проявляют щелочные металлы благодаря электронной конфигурации?
Благодаря электронной конфигурации, атомы щелочных металлов проявляют такие свойства, как металлический блеск, мягкость, низкую плотность и низкую температуру плавления. Они также обладают высокой реакционностью и способностью образовывать щелочные гидроксиды и соли в химических реакциях.
