Атом щелочного металла является одним из наиболее простых и изученных объектов в химии и физике. Он состоит из ядра, окруженного электронной оболочкой. Электронная структура атома определяет его химические и физические свойства, и исследование этой структуры является важным шагом для понимания поведения щелочных металлов.
Атомы щелочных металлов имеют одну валентную электрон в самом внешнем энергетическом уровне. Это означает, что они легко отдают этот электрон, что делает их очень реактивными. Это также делает их хорошими проводниками тепла и электричества.
Электронная структура атома щелочного металла описывается с помощью электронной конфигурации. В электронной конфигурации указывается, сколько электронов находится на каждом энергетическом уровне и подуровне. Например, для атома лития электронная конфигурация выглядит следующим образом: 1s^2 2s^1. Это означает, что внешний энергетический уровень атома лития содержит 2 электрона, а самый внешний подуровень - 1 электрон.
Изучение электронной структуры атома щелочного металла позволяет понять, как образуется ион этого металла и какие соединения он может образовать с другими элементами. Также данная информация имеет практическое применение, например, в определении свойств материалов, используемых при создании электронных устройств.
Изучаем электронную структуру атома щелочного металла

Электронная структура атома щелочного металла играет важную роль в его химических свойствах. Щелочные металлы, такие как литий, натрий и калий, обладают одной валентной электронной оболочкой, что делает их очень реактивными. Заполнение этой оболочки электронами влияет на химическую активность щелочных металлов и их способность образовывать ионные соединения.
В электронной структуре атома щелочного металла внешний электрон находится в s-подуровне. Скорость и энергия этого электрона определены его движением вокруг ядра атома. Этот электрон является валентным и отвечает за реактивность щелочных металлов.
Электронные конфигурации щелочных металлов можно представить с использованием обозначений квантовых чисел. Например, литий имеет электронную конфигурацию 1s2 2s1, что означает, что он имеет два электрона внутренней 1s-подуровне и один внешний электрон в 2s-подуровне. Натрий имеет электронную конфигурацию 1s2 2s2 2p6 3s1, а калий - 1s2 2s2 2p6 3s2 3p6 4s1.
Изучение электронной структуры атома щелочного металла позволяет понять, какие элементы могут образовывать связи с другими атомами и какие соединения могут образовываться. Щелочные металлы, благодаря своей электронной структуре, обладают способностью образовывать ионные соединения с атомами других элементов, что делает их важными для многих химических реакций и промышленных процессов.
Атом щелочного металла: что это такое?
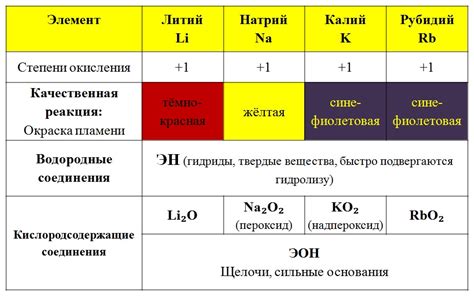
Атом щелочного металла представляет собой особый вид атома, относящийся к группе элементов периодической системы, включающей литий, натрий, калий, рубидий, цезий и франций. Щелочные металлы характеризуются наличием одного электрона в валентной оболочке, что делает их очень реакционноспособными.
Каждый атом щелочного металла имеет общую электронную конфигурацию ns^1, где n - номер энергетического уровня. Одиночный электрон на внешнем уровне сделает атом нестабильным и стремящимся образовать ион положительного заряда, отдавая этот электрон другому атому или молекуле.
Атомы щелочных металлов славятся еще одним уникальным свойством - фотоэмиссией. Благодаря низкой энергии ионизации, которая обусловлена наличием одного электрона на внешнем уровне, атомы щелочных металлов способны испускать электроны при воздействии света. Это свойство широко используется в промышленности для создания фотоэлектрических элементов и ламп.
Атом щелочного металла является ключевым элементом в химических реакциях, таких как образование солей и обмен ионами. Его реакционная способность и свойство фотоэмиссии делают щелочные металлы востребованными во многих областях науки и техники, а также в повседневной жизни.
Электронная оболочка атома щелочного металла: особенности
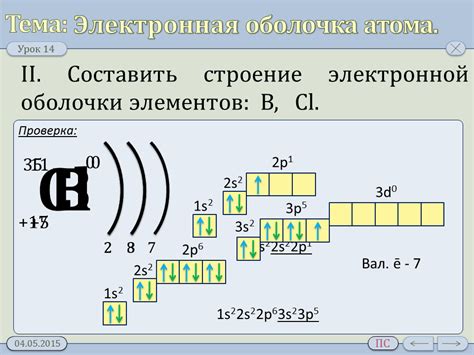
Атомы щелочных металлов, таких как литий, натрий, калий и др., имеют особенности в своей электронной оболочке. В основном состоянии, эти атомы имеют один электрон в внешней оболочке. Отсюда их химические свойства и реактивность.
Атомы щелочных металлов характеризуются наличием одного электрона в s-подобной орбитали внешней оболочки. Этот электрон представляет собой валентный электрон, именно с ним взаимодействуют другие атомы и молекулы в химических реакциях. Из-за наличия только одного электрона во внешней оболочке, атомы щелочных металлов являются металлическими рентгенами.
Электронная оболочка атома щелочного металла также характеризуется положительным зарядом ядра, которому противостоит единственный отдельный валентный электрон. Именно этот электрон определяет химические свойства щелочных металлов и делает их реактивными в реакциях с другими веществами.
Соединения щелочных металлов образуются благодаря этому отдельному валентному электрону. В реакциях этот электрон может передаваться другим атомам или молекулам, образуя положительно заряженные ионы щелочных металлов. Также этот электрон может участвовать в образовании химических связей, образуя соединения веществ с другими элементами.
Внешний электронный слой атома щелочного металла
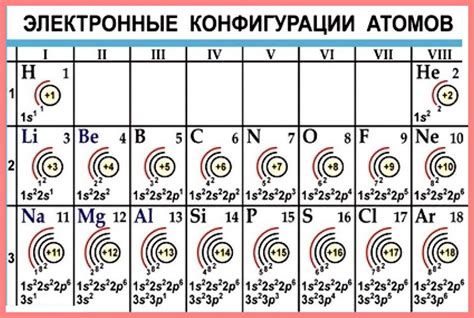
Щелочные металлы - это элементы периодической таблицы, которые находятся в первой группе (IA). Внешний электронный слой атома щелочного металла состоит из одного электрона, который находится в s-подуровнении.
Например, натрий (Na) имеет атомный номер 11, что означает, что он имеет 11 электронов. Поскольку он находится в первой группе, натрий имеет одного электрона во внешнем электронном слое, который находится в s-подуровне.
Этот электрон внешнего слоя является основным фактором, определяющим химические и физические свойства щелочных металлов. Он легко участвует в химических реакциях, поскольку слой с s-подуровнем находится на большом расстоянии от ядра атома и слабо удерживается электростатическим притяжением.
Электрон внешнего слоя легко отделяется от основного атома щелочного металла и образует положительно заряженный ион. Например, натрий может легко потерять свой единственный внешний электрон, став позитивно заряженным ионом Na+, который образует ионы Na+ в реакциях образования солей или образования соединений с другими элементами.
Влияние электронной структуры на свойства щелочных металлов
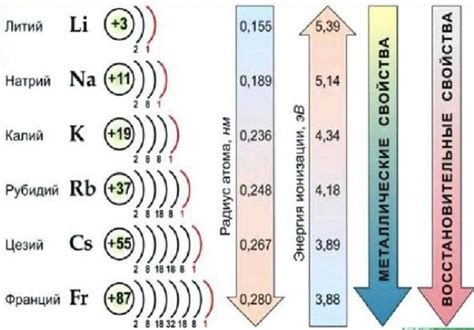
Электронная структура играет важную роль в определении свойств щелочных металлов. Щелочные металлы, такие как литий, натрий и калий, отличаются от других элементов периодической таблицы своей реакционной способностью и металлическими свойствами.
Основная особенность электронной структуры щелочных металлов заключается в том, что их внешний электронный уровень состоит всего из одного электрона. Этот электрон является слабо связанным с ядром и легко участвует в химических реакциях. Именно эта химическая активность делает щелочные металлы такими реакционноспособными и их соединения широко применяемыми в промышленности.
Другой важной особенностью щелочных металлов является их низкая плотность. Это связано с наличием большого электронного облака вокруг ядра атома, которое создает отталкивающие силы между атомами и делает металлы легкими и мягкими.
Способность щелочных металлов образовывать ионы с положительным зарядом также обусловлена их электронной структурой. Однако, несмотря на высокую реакционность и низкую электроотрицательность щелочных металлов, они образуют стабильные ионы благодаря особенностям их электронной конфигурации.
В целом, электронная структура щелочных металлов определяет их химические и физические свойства, а также их реакционную способность. Изучение этих свойств помогает понять механизмы химических реакций и применять щелочные металлы в различных областях науки и техники.
Применение знаний об электронной структуре атома щелочного металла

Изучение электронной структуры атомов щелочных металлов имеет большое практическое значение в различных областях науки и техники. Знание количества электронов в различных энергетических уровнях атомов позволяет понять и объяснить множество свойств и реакций этих металлов.
Одно из основных применений электронной структуры щелочных металлов - это их использование в химических реакциях, в том числе в процессе синтеза новых соединений. Знание электронной структуры позволяет предсказать способность атомов щелочных металлов образовывать ионные соединения с другими элементами. Это знание особенно полезно в химической промышленности, где ионы щелочных металлов играют важную роль в синтезе различных веществ и материалов.
Кроме того, электронная структура атомов щелочных металлов также имеет большое значение в физике. В настоящее время они активно применяются в электронике, в процессе создания электронных компонентов и полупроводников. Изучение электронной структуры помогает в понимании проводимости и магнитных свойств щелочных металлов, что открывает новые возможности для разработки новых материалов и технологий.
Кроме того, знание электронной структуры атомов щелочных металлов также важно в биологии и медицине. Щелочные металлы играют важную роль в организме человека и других живых организмов. Например, калий и натрий являются ключевыми макроэлементами, необходимыми для нормальной работы клеток и органов. Изучение электронной структуры помогает понять, как эти элементы взаимодействуют с другими молекулами в организме и влияют на его функции.
Вопрос-ответ

Что такое электронная структура атома щелочного металла?
Электронная структура атома щелочного металла описывает распределение электронов в энергетических уровнях и подуровнях атома этого металла. Она включает информацию о количестве электронов на каждом уровне и подуровне, а также об их энергии и магнитном моменте.
Какие особенности электронной структуры атома щелочного металла?
Основной особенностью электронной структуры атома щелочного металла является наличие одного электрона в валентной оболочке. Это делает эти металлы хорошими металлическими проводниками и способствует их активности в химических реакциях.
Почему атомы щелочных металлов стабилизируются путем отдачи электрона во внешнюю оболочку?
Атомы щелочных металлов стабилизируются отдачей электрона во внешнюю оболочку, потому что этот процесс позволяет им достичь электронной конфигурации инертного газа и тем самым стать более стабильными. Отдача лишнего электрона также ведет к образованию ионов с положительным зарядом, которые проявляют химическую активность.
Как влияет электронная структура атома щелочного металла на его свойства?
Электронная структура атома щелочного металла с одним электроном в валентной оболочке делает его хорошими металлическими проводниками. Это объясняется тем, что свободный электрон в валентной оболочке может легко перемещаться по кристаллической решетке металла и обеспечивать электрическую проводимость. Это также делает щелочные металлы активными в химических реакциях, поскольку они готовы отдавать свой валентный электрон и образовывать положительные ионы.
