Электронная конфигурация является важным аспектом изучения внешних уровней щелочных металлов. Щелочные металлы, такие как литий, натрий, калий и т. д., имеют общую особенность - наличие одного электрона во внешней электронной оболочке. Этот электрон является валентным электроном и определяет химические свойства щелочных металлов.
Электронная конфигурация внешнего уровня определяется расположением валентного электрона на энергетической диаграмме атома. Каждый щелочный металл имеет свою уникальную электронную конфигурацию внешнего уровня. Например, литий имеет электронную конфигурацию 2s1, что означает наличие одного электрона на s-орбитали внешней оболочки. Натрий имеет электронную конфигурацию 3s1, а калий - 4s1.
Важно отметить, что внешний электронный уровень щелочных металлов является достаточно неустойчивым из-за слабого притяжения ядра. Это делает эти металлы исключительно реактивными и склонными к образованию ионов положительного заряда. Именно этот факт определяет химические свойства щелочных металлов, такие как их реактивность, способность образовывать соли и электронное строение соединений, включая ионы.
Что такое электронная конфигурация внешнего уровня щелочного металла?
Электронная конфигурация внешнего уровня щелочного металла описывает расположение электронов на последнем заполненном энергетическом уровне в атоме данного металла. Щелочные металлы состоят из первой группы периодической системы, включающей литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
У этих элементов внешний энергетический уровень содержит только одну электронную оболочку, обычно обозначаемую s-подуровнем. Электронная конфигурация внешнего уровня щелочных металлов может быть представлена следующим образом: 1s2 2s2 2p6 3s1.
Последний электрон внешней оболочки, который может участвовать в химических реакциях, называется валентным электроном. В случае щелочных металлов валентный электрон находится на s-подуровне, что делает их очень реактивными и способными легко образовывать ионы положительного заряда.
Электронная конфигурация внешнего уровня щелочных металлов определяет их химические свойства. Они обладают большой активностью и способностью образовывать стабильные ионы с единичным положительным зарядом. Это связано с тем, что валентный электрон щелочных металлов находится в относительно слабо связанном s-подуровне, что легко позволяет ему уйти во внешнюю среду и образовать соединения с другими элементами.
Физические особенности внешнего уровня щелочных металлов

Внешний уровень щелочных металлов представлен последней оболочкой электронов в их атомах. Все элементы этой группы имеют одну общую октетную конфигурацию с одним электроном на s-орбитали. Такая электронная структура определяет особенности физических свойств этих металлов.
Внешний электронный уровень щелочных металлов оказывает существенное влияние на их химическую активность и электронные свойства. Эти элементы обладают сверхвалентными свойствами, что означает, что они способны образовывать ионы с зарядом больше 1+ путем потери электрона. Наличие одного электрона на внешнем уровне облегчает процессы окисления и образования связей с другими элементами.
Физическими свойствами щелочных металлов характеризуются низкой плотностью, низкой температурой плавления и высокой теплопроводностью. Также они обладают низкой твердостью и высокой подвижностью электронов, что делает их хорошими проводниками тока и тепла. Более того, наличие одного свободного электрона на внешнем уровне придает щелочным металлам характерные металлические свойства, такие как блеск, способность образовывать сплавы, а также высокую реакционную способность.
Кроме того, внешний уровень щелочных металлов обуславливает их способность образовывать ионы с отрицательным зарядом. Это позволяет создавать структуры кристаллов и соединений с другими элементами, что приводит к формированию разнообразных соединений щелочных металлов, таких как хлориды, оксиды, сульфаты и другие.
Атомная структура внешнего уровня щелочных металлов

Щелочные металлы - это элементы первой группы периодической таблицы. Их атомная структура обладает особенностями, отличающими их от элементов других групп. Наиболее характерной особенностью щелочных металлов является их электронная конфигурация внешнего энергетического уровня.
Ущелье энергетического уровня щелочных металлов, на котором находятся внешние электроны, называется s-орбиталью. В отличие от остальных элементов, у которых внешние уровни могут иметь p- или d-орбитали, щелочные металлы имеют только s-орбитали на своем внешнем уровне.
Энергетический уровень щелочных металлов содержит только одну электронную s-подобную оболочку, обозначаемую как ns1, где n - номер энергетического уровня. Например, для лития (Li) - это 2s1, для натрия (Na) - 3s1 и так далее. Внешний электрон щелочных металлов находится на s-орбитали и может участвовать в химических реакциях и связях с другими элементами.
Электронная конфигурация внешнего уровня щелочных металлов обуславливает их химические свойства. Внешний электрон легко отдается или принимается, что делает щелочные металлы хорошими донорами электронов. Они образуют ионные и ковалентные связи с другими элементами, принимая участие в образовании различных соединений. Это свойство щелочных металлов делает их важными компонентами в различных химических и биологических процессах.
Правило заполнения электронных оболочек щелочных металлов
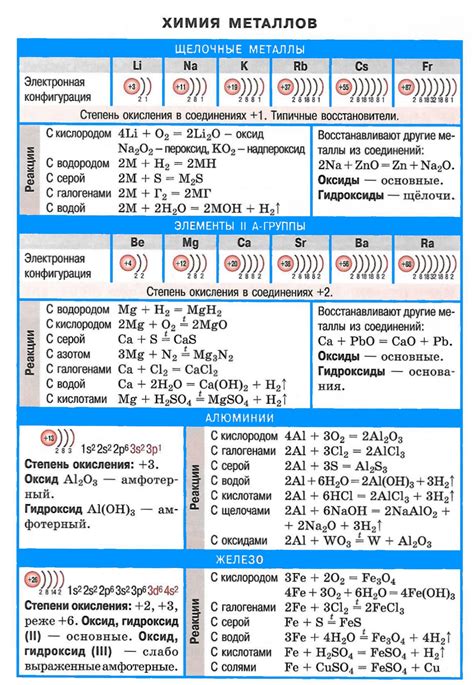
Электронная конфигурация щелочных металлов обусловлена их положением в периодической системе. Эти элементы находятся в первой группе и имеют всего один электрон во внешней энергетической оболочке.
Согласно правилу заполнения электронных оболочек, электроны в атоме заполняют энергетические уровни по возрастанию их энергии. Для щелочных металлов это означает, что внешняя энергетическая оболочка будет заполнена всего одним электроном, который находится на уровне с наименьшей энергией.
Например, электронная конфигурация лития (Li) представляет собой 1s2 2s1, что означает наличие двух электронов на 1s-уровне и одного электрона на 2s-уровне. Это объясняется тем, что энергия 2s-уровня ниже энергии 2p-уровня, на котором находятся элементы более высоких групп.
Щелочные металлы стремятся отдать свой внешний электрон, чтобы достичь электронной конфигурации инертного газа. На свободном воздухе щелочные металлы легко реагируют с водой и кислородом, пытаясь отдать свой внешний электрон и образовать стабильные ионы.
В целом, правило заполнения электронных оболочек щелочных металлов определяется их положением в периодической системе и стремлением достичь более устойчивой электронной конфигурации, что приводит к характерным свойствам этих элементов.
Энергетические уровни и электронные подуровни щелочных металлов
Щелочные металлы, такие как литий, натрий, калий и др., имеют химические свойства, связанные с особенностями их электронной конфигурации. На энергетическом уровне и электронных подуровнях этих элементов базируются их химические свойства, включая хорошую реактивность и способность образовывать ионы положительных зарядов.
у атомов щелочных металлов на внешнем энергетическом уровне находится только один электрон. Этот электрон находится на s-подуровне и обладает наибольшей энергией среди всех электронов в атоме. Поэтому он наиболее активен и легко участвует в химических реакциях.
В оболочке щелочных металлов имеется еще один s-подуровень, который заполнен до предыдущего энергетического уровня. На нем находится 8 электронов, что делает оболочку стабильной. Также присутствуют p-подуровни с 6 электронами. Поскольку p-подуровни находятся на более высоком уровне энергии, они слабее удерживаются атомом и легко отдают свои электроны при вступлении в химические реакции.
Энергия ионообразования щелочных металлов
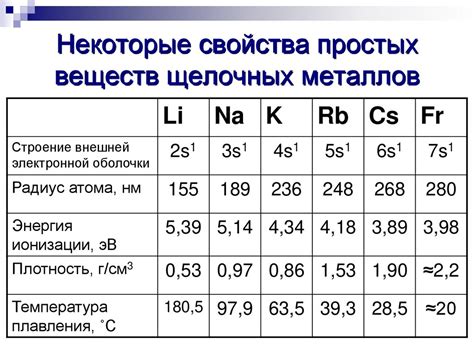
Энергия ионообразования щелочных металлов является характеристикой, описывающей энергию, необходимую для удаления одного электрона с атома щелочного металла в газовой фазе. Эта величина зависит от структуры и электронной конфигурации атома.
Все щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, обладают одним электроном в валентной оболочке. Это делает их чрезвычайно реактивными, так как они стремятся сбросить этот электрон и образовать положительный ион. Кроме того, у всех щелочных металлов низкая электроотрицательность, что способствует легкому удалению электрона.
Энергия ионообразования щелочного металла связана со свойствами его атома и определяется притяжением ядра к электрону. Чем больше заряд ядра и меньше радиус атома, тем выше энергия ионообразования. Так, у лития энергия ионообразования ниже, потому что заряд ядра ниже, а радиус атома больше, по сравнению с остальными щелочными металлами. Наоборот, у цезия энергия ионообразования выше вследствие большего заряда ядра и меньшего радиуса атома.
Энергия ионообразования щелочных металлов имеет важное практическое значение в различных областях науки и техники. Например, в химических реакциях ионы щелочных металлов могут образовывать стабильные соединения с другими элементами, что позволяет использовать их в производстве химических соединений и материалов. Кроме того, эти металлы являются важными компонентами в батареях и электронных устройствах, где высокая энергия ионообразования обеспечивает стабильность работы и длительный срок службы.
Особенности электронной конфигурации внешнего уровня щелочных металлов

Щелочные металлы – это элементы первой группы периодической системы элементов. Эти металлы включают литий, натрий, калий, рубидий, цезий и франций. Одной из особенностей электронной конфигурации внешнего уровня щелочных металлов является наличие одного электрона на этом уровне.
Каждый из щелочных металлов имеет свою собственную электронную конфигурацию, к примеру, у лития на внешнем уровне находится один s-электрон, у натрия – один s-электрон и три p-электрона, у калия – один s-электрон и три p-электрона, у рубидия – один s-электрон и три p-электрона, у цезия – один s-электрон и три p-электрона, а у франция – один s-электрон и четыре p-электрона.
Электроны на внешнем уровне щелочных металлов легко участвуют в химических реакциях и образуют ионы с положительным зарядом. Это связано с тем, что внешний уровень щелочных металлов не заполнен. Когда щелочные металлы образуют ионы, они теряют внешний электрон и превращаются в положительные ионы с зарядом, равным числу внешних электронов, которые были потеряны.
Взаимодействие электронов на внешнем уровне щелочных металлов с другими атомами и ионами ведет к формированию различных химических соединений. Щелочные металлы являются очень реактивными элементами и имеют большое значение в области химии и технологии. Они используются в процессах синтеза различных соединений, в производстве технических сплавов и при изготовлении различных изделий.
Примеры электронной конфигурации внешнего уровня щелочных металлов

Щелочные металлы, такие как литий (Li), натрий (Na), калий (K), рубидий (Rb) и цезий (Cs), имеют общую особенность - на внешнем электронном уровне у них всего один электрон. Такая электронная конфигурация является причиной химической активности щелочных металлов.
Например, электронная конфигурация внешнего уровня лития - 2s1. Это значит, что на внешнем электронном уровне лития находится один электрон, который имеет собственный магнитный момент и способствует формированию особых химических связей.
У натрия электронная конфигурация внешнего уровня - 3s1. Это означает, что внешний электронный уровень натрия также содержит один электрон. Это делает натрий реактивным элементом, способным образовывать соединения с другими элементами.
Калий имеет электронную конфигурацию внешнего уровня 4s1, рубидий - 5s1, а цезий - 6s1. Во всех случаях на внешнем электронном уровне находится только один электрон. Это делает эти металлы химически активными и способными образовывать стабильные соединения с другими элементами.
Электронная конфигурация внешнего уровня щелочных металлов придает им способность к высокой активности в химических реакциях, а также способность формировать стабильные ионные соединения с другими элементами, например с галогенами, кислородом и серой.
Вопрос-ответ

Что такое электронная конфигурация внешнего уровня щелочного металла?
Электронная конфигурация внешнего уровня щелочного металла определяет расположение и количество электронов на самом внешнем энергетическом уровне атома. Для щелочных металлов внешний энергетический уровень содержит один электрон.
Какие щелочные металлы существуют и какой у них общий признак в электронной конфигурации внешнего уровня?
Существует 6 щелочных металлов: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Общий признак в электронной конфигурации внешнего уровня щелочных металлов - наличие одного электрона на внешнем энергетическом уровне.
Какая электронная конфигурация у внешнего уровня щелочного металла?
У внешнего уровня щелочного металла находится один электрон. Например, у лития (Li) электронная конфигурация внешнего уровня - 2s^1, у натрия (Na) - 3s^1 и так далее.
Почему электронная конфигурация внешнего уровня щелочного металла важна?
Электронная конфигурация внешнего уровня щелочного металла определяет его химические свойства и взаимодействие с другими элементами. Благодаря наличию одного электрона на внешнем энергетическом уровне, щелочные металлы имеют большую реакционную способность и легко образуют ионы с положительным зарядом.
