Щелочноземельные металлы - это группа химических элементов, которые находятся во второй группе (группа 2) периодической таблицы элементов. Эта группа включает в себя шесть элементов: бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Щелочноземельные металлы обладают рядом общих химических и физических свойств, одно из которых - их электронная конфигурация.
Электронная конфигурация щелочноземельных металлов определяет расположение электронов в их атомах. Внешний электронный уровень - это уровень энергии, на котором находятся внешние электроны, или электроны валентной оболочки, щелочноземельных металлов. Эти электроны играют важную роль в химических реакциях и взаимодействиях с другими элементами.
Внешний электронный уровень щелочноземельных металлов содержит два электрона, которые находятся в s-подуровне. Бериллий и магний имеют конфигурацию ns2, где n - номер энергетического уровня. Например, у бериллия внешний электронный уровень содержит два электрона, которые находятся на втором энергетическом уровне. Кальций, стронций, барий и радий имеют конфигурацию ns2np1, где n - номер энергетического уровня и p - тип орбитали, на которой находятся электроны. Например, у кальция внешний электронный уровень содержит два электрона, которые находятся на третьем энергетическом уровне в s-подуровне, и один электрон в p-подуровне.
Изучение электронной конфигурации щелочноземельных металлов позволяет лучше понять их химические свойства и взаимодействия с другими элементами. Внешний электронный уровень с двумя электронами делает эти металлы химически активными и способными образовывать ионы положительной заряды, что является основой их реактивности. Знание электронной конфигурации щелочноземельных металлов является важным элементом в химическом образовании и исследовании их химических свойств.
Щелочноземельные металлы
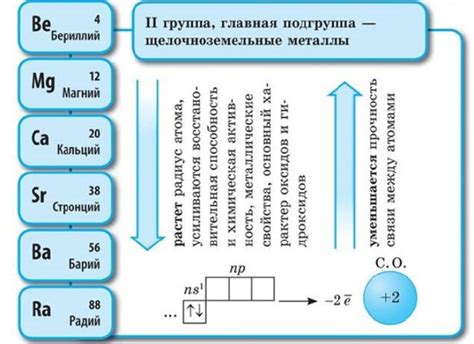
Щелочноземельные металлы - это группа элементов, включающая бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Они относятся ко 2-й группе периодической таблицы.
Все щелочноземельные металлы имеют два электрона на внешнем энергетическом уровне, что делает их достаточно химически активными. Эти металлы образуют ионы с положительным зарядом, отдавая оба электрона и становясь двухвалентными положительными ионами.
Щелочноземельные металлы обладают высокой электропроводностью и хорошей термической проводимостью, что делает их идеальными материалами для использования в проводниках и теплообменниках. Кроме того, они обладают низкой плотностью и хорошей прочностью, что делает их подходящими для использования в легких конструкциях.
Щелочноземельные металлы также используются в различных химических процессах и промышленных производствах. Например, бериллий используется в производстве сплавов, магний - в производстве алюминиевых сплавов, а кальций используется в производстве стали и цемента.
Щелочноземельные металлы имеют большое значение в биологии и медицине. Магний, кальций и стронций играют важные роли в клеточных процессах и функционировании организма. Кальций, например, является важным компонентом костей и зубов, а магний участвует в множестве ферментативных реакций.
Электронная конфигурация и общая характеристика щелочноземельных металлов

Щелочноземельные металлы являются элементами второй группы периодической системы. Эта группа состоит из шести элементов: бериллия (Be), магния (Mg), кальция (Ca), стронция (Sr), бария (Ba) и радия (Ra).
Электронная конфигурация щелочноземельных металлов характеризуется наличием двух электронов на внешнем энергетическом уровне (s-подуровне) в своей наиболее стабильной форме. Это даёт им общую химическую активность и делает их более реактивными, чем металлы предыдущей группы (щелочные металлы с одним электроном внешней оболочки).
Наиболее известными и широко используемыми щелочноземельными металлами являются магний и кальций. Магний широко применяется в авиационной и автомобильной промышленности, а также в производстве сплавов и легирования других металлов. Кальций используется в производстве строительных материалов, стекла, кожи и многих других отраслях.
Щелочноземельные металлы обладают низкой плотностью и хорошей электропроводностью. Они легко реагируют с кислородом и образуют оксиды, которые полезны в различных промышленных процессах. Кроме того, эти металлы способны образовывать стабильные соединения с другими элементами, что делает их важными компонентами в различных химических и фармацевтических продуктах.
В целом, щелочноземельные металлы обладают сходными химическими свойствами и имеют широкое применение в различных отраслях промышленности и науке благодаря своей активности и уникальным химическим свойствам.
Электронное строение
Электронное строение внешнего электронного уровня щелочноземельных металлов определяет их химические и физические свойства. Щелочноземельные металлы включают в себя бериллий, магний, кальций, стронций, барий и радий. У этих элементов внешний электронный уровень состоит из двух электронов.
На внешнем электронном уровне щелочноземельных металлов находятся s-электроны. Благодаря этому, щелочноземельные металлы характеризуются хорошей проводимостью электричества и тепла. Связь между внешним электронным уровнем и химическими свойствами щелочноземельных металлов проявляется, в частности, в реакциях с водой и кислородом.
Электронная конфигурация внешнего электронного уровня щелочноземельных металлов может быть представлена в виде таблицы. Например, для бериллия электронная конфигурация будет выглядеть так: 1s2 2s2. Для магния: 1s2 2s2 2p6 3s2. Для кальция: 1s2 2s2 2p6 3s2 3p6 4s2, и так далее.
Изучение электронной конфигурации внешнего электронного уровня щелочноземельных металлов позволяет лучше понять их химические свойства и реактивность. Она является ключевым фактором, определяющим взаимодействие щелочноземельных металлов с другими элементами и соединениями.
Внешний электронный уровень

Внешний электронный уровень является определяющим фактором для свойств щелочноземельных металлов. Он содержит только одну или две электронные оболочки, на которых находятся электроны внешней оболочки.
Для всех щелочноземельных металлов внешний электронный уровень состоит из s-электронов, то есть уровень s1 или s2. Это обусловлено тем, что щелочноземельные металлы находятся во втором периоде периодической системы и имеют соответствующую электронную конфигурацию.
Внешние электроны щелочноземельных металлов легко участвуют в химических реакциях, поскольку они находятся на наиболее отдаленном энергетическом уровне от ядра и слабо связаны с ним. Такие электроны образуют химическую связь с другими атомами и могут образовывать ионные и ковалентные соединения.
Количество внешних электронов варьирует в зависимости от появления следующего элемента в группе щелочноземельных металлов. Например, бериллий имеет два электрона на внешнем электронном уровне, а магний уже имеет три. Это объясняет различие в их химических свойствах и способности образовывать соединения.
Электронная конфигурация на примере магния

Магний - это щелочноземельный металл с атомным номером 12 в периодической системе элементов. У него есть два внешних электрона, которые находятся на третьем энергетическом уровне. Это значит, что электронная конфигурация магния выражается как 1s22s22p63s2.
Первые два электрона магния находятся в s-орбитали на первом энергетическом уровне. Затем следующие шесть электронов заполняют s- и p-орбитали на втором энергетическом уровне. Наконец, последние два электрона занимают s-орбиталь на третьем энергетическом уровне.
Электронная конфигурация магния можно также представить с помощью сокращенной записи: [Ne] 3s2. Здесь [Ne] обозначает заполненную оболочку нейтроновых электронов, которая является частью внутреннего ядра магния.
Такая электронная конфигурация позволяет магнию проявлять химическую активность. Он легко отдает свои два внешних электрона, что делает его хорошим реагентом в различных химических реакциях.
Электронная конфигурация на примере кальция

Кальций (Ca) - щелочноземельный металл, химический элемент с атомным номером 20 в периодической системе элементов. Его электронная конфигурация определяется расположением электронов на электронных орбиталях, где каждый орбиталь может вмещать определенное количество электронов.
В атоме кальция имеется два электрона на внешнем электронном уровне, обозначаемом как 4s. Этот электронный уровень имеет максимальную вместимость в 8 электронов. Поэтому электронная конфигурация кальция выглядит следующим образом: 1s2 2s2 2p6 3s2 3p6 4s2.
Данные об электронной конфигурации помогают понять химические свойства кальция. Наличие двух электронов на внешнем электронном уровне делает его реактивным металлом, способным легко отдавать эти электроны и образовывать положительные ионы Ca2+.
Кальций является важным элементом для живых организмов, так как играет ключевую роль в образовании и поддержании здоровых костей и зубов. Он также участвует в множестве физиологических процессов, включая передвижение мышц и передачу нервных импульсов. Из-за своего значимого вклада в здоровье человека, кальций является объектом многих исследований и может быть использован в качестве добавки в пищу и лекарств.
Электронная конфигурация на примере стронция
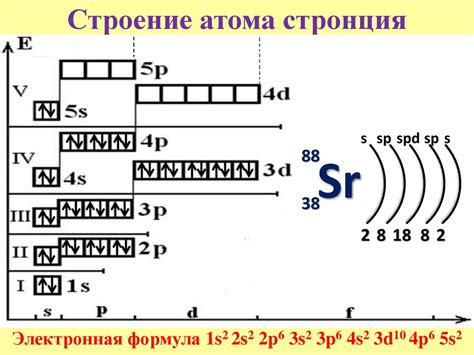
Стронций (Сr) является щелочноземельным металлом, который находится во второй группе периодической системы. Однако, его электронная конфигурация отличается от других металлов этой группы.
У стронция на внешнем электронном уровне находятся два электрона, которые располагаются в s-орбитале. Таким образом, электронная конфигурация стронция будет выглядеть следующим образом: 1s2 2s2 2p6 3s2 3p6 4s2.
Стоит отметить, что стронций входит в периодическую систему элементов после кальция (Ca) и имеет аналогичную электронную конфигурацию внешнего электронного уровня. Располагая двумя валентными электронами, стронций обладает ионными свойствами и может образовывать ионы, например, Sr2+.
Также стоит отметить, что стронций обычно находится в природе в виде солей, таких как силикаты и карбонаты. Благодаря своим свойствам, стронций находит применение в различных областях, включая промышленность, медицину и даже в производстве пиротехники.
Электронная конфигурация на примере бария
Барий (Ba) - щелочноземельный металл, относящийся к 2 группе периодической системы. Его атомный номер равен 56, что означает наличие 56 электронов в его атоме. Рассмотрим электронную конфигурацию бария.
Первые два электрона бария находятся на первом электронном уровне, обозначаемом как 1s. Следующие восемь электронов заполняют второй электронный уровень, обозначаемый как 2s и 2p. Таким образом, у бария уже заполнены все энергетические уровни до третьего.
На третьем энергетическом уровне бария находятся восемь электронов. Четыре из них заполняют 3s-орбиталь, а оставшиеся четыре распределяются по трех 3p-подуровням. Общая электронная формула третьего уровня - 3s23p6.
Четвертый энергетический уровень бария, обозначаемый как 4s, содержит еще два электрона. Следовательно, электронная конфигурация бария можно записать как [Xe] 6s24f145d106p67s2.
Таким образом, барий имеет полностью заполненные два энергетических уровня (с 1 по 6), а его внешний электрон находится на седьмом энергетическом уровне (7s), что делает его активным щелочноземельным металлом.
Вопрос-ответ

Какова электронная конфигурация внешнего электронного уровня щелочноземельных металлов?
Электронная конфигурация внешнего электронного уровня щелочноземельных металлов следующая: ns2, где n - номер энергетического уровня.
Какие элементы относятся к щелочноземельным металлам?
К щелочноземельным металлам относятся элементы второй группы периодической системы: бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra).
