Щелочные металлы – это группа химических элементов, которые находятся в первой группе периодической таблицы. Они включают в себя такие элементы, как литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
В электронной конфигурации щелочных металлов есть несколько особенностей. Во-первых, все щелочные металлы имеют внешний электрон в s-орбитали, что делает их очень реакционно-способными. Это связано с тем, что электроны в s-орбитали расположены ближе к ядру и менее защищены от внешних атомов.
Во-вторых, электронная конфигурация щелочных металлов имеет очень короткую последовательность. Например, у лития (Li) электронная конфигурация будет 1s² 2s¹. Это связано с тем, что элементы из первой группы имеют только один электрон в внешней энергетической оболочке. Эта короткая последовательность делает щелочные металлы хорошими источниками электронов в химических реакциях.
Щелочные металлы обладают несколькими характеристиками и свойствами, которые делают их полезными в различных областях. Они обладают низкой плотностью, высокой теплопроводностью, хорошей электропроводностью и низкой температурой плавления. Кроме того, они очень реакционно-способны и легко образуют ионы с положительным зарядом.
Электронная конфигурация щелочных металлов является основополагающим фактором, определяющим их химические свойства. Она указывает на то, сколько электронов находится в каждой энергетической оболочке и субоболочке. Знание электронной конфигурации помогает в понимании и объяснении химических реакций и свойств щелочных металлов.
Понятие электронной конфигурации

Электронная конфигурация – это способ представления распределения электронов в атоме щелочных металлов, который позволяет описать их энергетические уровни и радиусы.
Электронная конфигурация щелочных металлов основывается на принципе заполнения энергетических уровней. Каждый щелочный металл имеет свой собственный набор энергетических уровней и количество электронов. Поэтому электронная конфигурация может варьироваться в зависимости от исследуемого элемента.
Составляя электронную конфигурацию щелочных металлов, сначала заполняются электроны на наиболее низком энергетическом уровне (основном), затем на следующем по энергии и т.д. При заполнении уровней максимально используются правила запрета Паули и принцип строения по возрастающей энергии.
Электронная конфигурация была впервые предложена Льюисом и Косленом в начале XX века и стала одним из важных инструментов для изучения свойств атомов и молекул. Благодаря электронной конфигурации можно определить возможность соединения щелочных металлов с другими элементами и установить зависимость их химических свойств от структуры электронной оболочки.
Значение электронной конфигурации

Электронная конфигурация является основополагающим свойством атомов и играет важную роль в понимании их химического поведения. Она описывает распределение электронов в атоме по различным энергетическим уровням и подуровням.
Основное значение электронной конфигурации заключается в объяснении химической активности и свойств элементов. В случае щелочных металлов электронная конфигурация играет ключевую роль в их химической реактивности.
Щелочные металлы, такие как литий, натрий, калий и др., имеют общую химическую характеристику: они обладают одним валентным электроном в последней энергетической оболочке. Это делает их очень реактивными элементами, способными легко отдавать этот электрон и образовывать положительные ионы.
Электронная конфигурация щелочных металлов Li (1s2 2s1), Na (1s2 2s2 2p6 3s1) и K (1s2 2s2 2p6 3s2 3p6 4s1) позволяет предсказывать и объяснять их химическую реактивность и способность образовывать ионы.
Таким образом, электронная конфигурация щелочных металлов определяет их физические и химические свойства, включая низкую энергию ионизации, высокую реактивность и способность образовывать сильные основания.
Особенности электронной конфигурации щелочных металлов

Щелочные металлы - это элементы первой группы периодической системы, включающие литий, натрий, калий, рубидий, цезий и франций. Эти металлы обладают рядом особенностей в своей электронной конфигурации, которые определяют их свойства и химическую активность.
Первая особенность - все щелочные металлы имеют один электрон в своей внешней оболочке, которая имеет энергию, наиболее удаленную от ядра. Этот электрон легко ионизируется, что делает эти элементы хорошими металлами, способными образовывать положительные ионы. Они являются сильными восстановителями и хорошими ионизаторами.
Вторая особенность - электронный конфигурационный переход от s-блока к p-блоку. Литий и натрий имеют электронную конфигурацию, заканчивающуюся на s-орбитали. Однако, начиная с калия, s-электрон переходит на p-орбитали для заполнения внутренней электронной оболочки. Это делает наличие двух электронов на p-орбитали, что меняет свойства щелочных металлов и делает их менее активными и более химически стабильными.
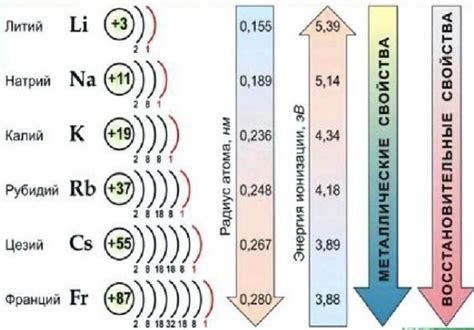
Третья особенность - расширение электронной оболочки при переходе от лития к францию. У щелочных металлов химические и физические свойства электронной оболочки постепенно меняются при переходе от лития к францию. Увеличивается размер атомов и их радиусы, а энергии ионизации снижаются. Это связано с увеличением количества электронов и дальностью их движения от ядра.
В целом, электронная конфигурация щелочных металлов играет важную роль в определении их свойств и поведения в химических реакциях. Знание этих особенностей позволяет более полно понять и использовать щелочные металлы в различных областях науки и техники.
Атомные и молекулярные формы щелочных металлов
Щелочные металлы являются химической группой элементов, которые находятся в первой группе периодической системы. Они включают литий (Li), натрий (Na), калий (K), рубидий (Rb) и цезий (Cs). Щелочные металлы характеризуются наличием одного электрона во внешней оболочке атома и, в результате, обладают высокой реактивностью и способностью образования ионов с положительным зарядом.
Атомы щелочных металлов образуют отдельные атомные формы, в которых каждый атом связан с соседними атомами электронными связями. Эти атомные формы обычно образуют кубическую кристаллическую решетку. Однако, в условиях низких температур, щелочные металлы могут образовывать молекулы, в которых два атома щелочного металла связаны между собой. Такие молекулярные формы щелочных металлов обычно называются димерами.
Молекулярные формы щелочных металлов имеют ряд особенностей и свойств. В отличие от атомных форм, димеры щелочных металлов обладают более низкой реактивностью и более высокой устойчивостью. Это связано с тем, что образование двойной связи между атомами металла снижает его склонность к реакциям с другими веществами.
Молекулярные формы щелочных металлов также обладают некоторыми интересными физическими свойствами. Например, димеры натрия и калия образуют жидкости с низкой температурой плавления и высокой теплопроводностью. Эти свойства делают их полезными в различных промышленных процессах, таких как охлаждение электронных компонентов или смазка механических узлов.
Строение электронных оболочек щелочных металлов

Щелочные металлы – это элементы первой группы периодической системы химических элементов, включающих литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они характеризуются уникальной электронной конфигурацией, которая обуславливает их основные свойства.
Электронные оболочки щелочных металлов содержат всего одну электронную оболочку, что делает их весьма реакционноспособными элементами. Это связано с тем, что электроны в последней оболочке находятся на большом удалении от ядра и слабо удерживаются электростатическим притяжением ядра. Заполнение электронной оболочки щелочных металлов происходит согласно правилу Ауфбау, сначала заполняются энергетически более низкие орбитали.
Каждый щелочный металл имеет один валентный электрон, расположенный в s-подуровне последней энергетической оболочки. Взаимодействие этого электрона с другими атомами и ионами позволяет щелочным металлам проявлять химическую активность и образовывать соединения с разными элементами.
Электронная конфигурация щелочных металлов может быть представлена следующим образом: для лития – 1s2 2s1; для натрия – 1s2 2s2 2p6 3s1; для калия – 1s2 2s2 2p6 3s2 3p6 4s1; и так далее.
Из-за своей активности щелочные металлы обычно находятся в химических соединениях, например, с кислородом или халогенами, в результате чего образуются щелочные гидроксиды и щелочные соли. Их способность образовывать ионы положительного заряда и реакционность делают щелочные металлы важными для многих процессов в природе и промышленности.
Свойства щелочных металлов

1. Воспламеняемость: Щелочные металлы, такие как литий (Li), натрий (Na), калий (K), рубидий (Rb) и цезий (Cs), сильно реактивны и легко воспламеняются при контакте с воздухом или водой. Их воспламеняемость обусловлена высокой реакционной способностью, часто приводящей к образованию горючих газов или воспламенения воздуха.
2. Реакция с водой: Щелочные металлы проявляют сильную реакцию с водой, в результате которой образуются щелочные гидроксиды и высвобождается водород. Эта реакция очень интенсивна и сопровождается выделением большого количества тепла.
3. Мягкость: Щелочные металлы обладают мягкостью и низкой температурой плавления. Их мягкость позволяет легко резать или формировать их поверхность при помощи ножа или ножниц. Например, кусок калия (K) можно легко разрезать на две части при помощи обычного ножа.
4. Способность к образованию ионов: Щелочные металлы имеют одно электрон во внешней электронной оболочке, что делает их очень реактивными. Они легко отдают это электрон и образуют положительно заряженные ионы. Это является основой для множества реакций, в которых щелочные металлы активно участвуют.
5. Окрашивание пламени: Щелочные металлы оказывают значительное влияние на окраску пламени. Например, при сжигании натрия (Na) или калия (K) в пламени образуются яркие оранжево-желтые и фиолетово-красные оттенки соответственно. Это свойство широко используется в пиротехнике и фейерверках для создания разнообразных цветовых эффектов.
6. Химическая активность: Щелочные металлы являются химически активными элементами и способны взаимодействовать с большим количеством веществ. Они реагируют с кислородом, хлором, серой и другими элементами, образуя различные химические соединения. Это свойство делает их важными компонентами для производства различных химических соединений и материалов.
Металлические свойства щелочных металлов

Щелочные металлы, такие как литий (Li), натрий (Na), калий (K), рубидий (Rb) и цезий (Cs), обладают рядом характерных металлических свойств. Все щелочные металлы являются отличными проводниками электричества и тепла, что делает их ценными материалами для применения в электронике и энергетике. Эти металлы обладают высокой электропроводностью благодаря наличию валентных электронов, которые легко перемещаются по их кристаллической решетке.
Одной из особенностей металлических свойств щелочных металлов является их низкое плавление и кипение. Например, литий плавится при температуре всего 180,5 °C, а цезий – при 28,4 °C. Это делает эти металлы подходящими для использования в различных технических приложениях, где требуется низкая температура плавления.
Щелочные металлы также обладают химической реактивностью. Они легко реагируют с водой, выделяя водород и образуя щелочные гидроксиды. Например, реакция калия с водой протекает очень быстро и с выделением значительного количества тепла. Это свойство калия делает его опасным для хранения и использования без необходимых мер предосторожности.
За счет своей высокой реактивности, щелочные металлы образуют разнообразные химические соединения с другими элементами. Например, они могут образовывать соли с кислородсодержащими анионами, такими как сульфаты и нитраты. Эти соединения находят широкое применение в различных отраслях промышленности и научных исследованиях.
В заключение, металлические свойства щелочных металлов определяют их уникальные характеристики и применение в различных сферах жизни. Они являются отличными проводниками электричества и тепла, обладают низкой температурой плавления и высокой реактивностью, что делает их важными материалами для множества технических и химических процессов.
Химические свойства щелочных металлов

Щелочные металлы - это группа элементов периодической таблицы, включающая литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). У этих металлов характерны особые химические свойства, определяющие их реактивность и поведение в различных реакциях.
Основной химической особенностью щелочных металлов является восприимчивость кислорода и влаги. Они активно реагируют с водой, образуя щелочные гидроксиды и выделяя водород. Например, реакция натрия с водой приводит к образованию гидроксида натрия и выделению водорода:
2Na + 2H2O -> 2NaOH + H2
Щелочные металлы также демонстрируют высокую реакционную способность с кислотами, что приводит к образованию солей. Например, реакция калия с хлороводородной кислотой приводит к образованию хлорида калия и выделению водорода:
K + HCl -> KCl + H2
Щелочные металлы обладают также высокой активностью по отношению к кислому окислителю кислороду. Они способны сгорать на воздухе, образуя оксиды, такие как оксид натрия или оксид калия:
4Na + O2 -> 2Na2O
Интересно отметить, что в свежесинтезированном состоянии щелочные металлы имеют яркий металлический блеск, однако при взаимодействии с кислородом из воздуха они быстро окисляются и образуют оксиды или гидроксиды. Химические свойства щелочных металлов делают их востребованными в различных промышленных процессах и находят применение в производстве сплавов и основных материалов.
Физические свойства щелочных металлов:

1. Реактивность:
Щелочные металлы являются самыми реактивными металлами в периодической системе. Они быстро реагируют с водой, кислородом и другими веществами. Реакция с водой особенно интенсивна, и в результате металлы щелочных металлов могут выделяться водород. Это делает щелочные металлы очень опасными для хранения и использования.
2. Плотность:
Щелочные металлы обладают низкой плотностью, что делает их легкими и мягкими. Например, литий – самый легкий из щелочных металлов и имеет плотность всего 0,53 г/см³. Калий и натрий имеют плотность 0,86 г/см³ и 0,97 г/см³ соответственно.
3. Температура плавления:
У щелочных металлов очень низкая температура плавления. Например, литий плавится при температуре всего 180 °C, что является самой низкой температурой плавления среди всех металлов. Калий плавится при 63 °C, натрий – при 98 °C. Это свойство делает щелочные металлы идеальными для использования в технологиях с низким температурным диапазоном.
4. Электропроводность:
Щелочные металлы являются хорошими проводниками электричества. Их электропроводность обусловлена свободными электронами в валентной оболочке, которые легко передвигаются по металлической решетке. Это свойство делает щелочные металлы важными в различных электронных устройствах и проводах.
5. Оттенок пламени:
Когда щелочные металлы сгорают в пламени, они придают ему характерный цвет. Литий придает пламени красный цвет, натрий – желтый, калий – фиолетовый. Это явление используется в фейерверках для создания разноцветных эффектов.
Вопрос-ответ

Что такое электронная конфигурация щелочных металлов?
Электронная конфигурация щелочных металлов - это распределение электронов в атомах данных элементов. В атомных оболочках щелочных металлов находится 1 электрон в s-подуровне. Например, у лития (Li) электронная конфигурация 1s²2s¹, а у натрия (Na) - 1s²2s²2p⁶3s¹.
Почему щелочные металлы так реакционны?
Щелочные металлы так реакционны из-за своей электронной конфигурации. У них всего один электрон во внешней электронной оболочке, и они стремятся избавиться от него, чтобы достичь стабильной конфигурации с полностью заполненной предыдущей энергетической оболочкой. Поэтому они легко реагируют с другими веществами, чтобы отдать свой электрон.
