Электронная конфигурация щелочноземельного металла определяет расположение и энергетическое состояние его электронов. Внешняя оболочка щелочноземельных металлов содержит электроны, определяющие их химические свойства и реактивность. В данном случае электронная конфигурация описывает расположение электронов конкретного щелочноземельного металла.
Электронная конфигурация 4s2 4p1 4s1 4s2 3d1 4s2 говорит о том, что внешняя оболочка данного щелочноземельного металла содержит 2 электрона в подуровне 4s, 1 электрон в подуровне 4p, 1 электрон в подуровне 4s, 2 электрона в подуровне 3d и еще 2 электрона в подуровне 4s.
Щелочноземельные металлы обладают общими химическими свойствами, такими как высокая реактивность и алкальность. Они образуют соединения с различными элементами, обычно отдавая свои два электрона в подуровне 4s, чтобы достигнуть стабильности и превратиться в катионы. Благодаря наличию одного электрона в подуровне 4p, щелочноземельные металлы также могут образовывать соединения с элементами, осуществляя обмен электронами и образуя синтетические минералы и сплавы.
В заключение, электронная конфигурация внешней оболочки щелочноземельного металла 4s2 4p1 4s1 4s2 3d1 4s2 определяет его химические свойства и способность образовывать соединения. Этот щелочноземельный металл обладает высокой реактивностью и способностью образовывать катионы, что делает его важным элементом во многих химических реакциях и процессах.
Электронная конфигурация щелочноземельного металла

Щелочноземельные металлы являются группой элементов в таблице Mendeleev. Их электронная конфигурация имеет общую структуру, которая описывает расположение электронов во внешней оболочке атома.
Одним из представителей щелочноземельных металлов является элемент с атомным номером 4s2 4p1 4s1 4s2 3d1 4s2. В нем внешняя оболочка содержит два электрона (4s2). Внутренняя оболочка содержит электроны в следующих подуровнях: 4s1, 4p1, 4s1, 4s2 и 3d1.
Электронная конфигурация щелочноземельного металла представляет собой атом с 20 электронами, расположенными в оболочках разных энергетических уровней. Внешние электроны играют ключевую роль в химических свойствах элемента и его способности образовывать соединения.
В данном щелочноземельном металле внешняя оболочка содержит два s-электрона, которые легко участвуют в химических реакциях. Это делает металл химически активным и способным образовывать ионные соединения.
Электронная конфигурация щелочноземельного металла имеет свою важность в области химии и материаловедения. Изучая ее можно предсказать возможные свойства элемента и его взаимодействие с другими веществами. Это помогает в разработке новых материалов и в процессе синтеза химических соединений.
Определение щелочноземельных металлов

Щелочноземельные металлы - это элементы, относящиеся к II группе периодической таблицы Менделеева. Они включают бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra).
Эти металлы обладают довольно высокими температурами плавления и кипения, низкими удельными весами и неактивными химическими свойствами. Однако они достаточно реактивны и образуют соединения с кислородом, серой и другими неметаллами.
Щелочноземельные металлы имеют характерные электронные конфигурации, которые определяют их химические свойства. Одной из особенностей этих металлов является наличие двух электронов в внешней s-оболочке.
Щелочноземельные металлы широко используются в различных промышленных отраслях. Например, бериллий используется в производстве сплавов, магний применяется в авиационной промышленности, а кальций используется в строительстве и в производстве стекла.
Важно отметить, что щелочноземельные металлы имеют ограниченную распространенность в земной коре и часто встречаются в виде минералов. Их добыча и производство требуют особых технологий и ресурсов.
Состав внешней оболочки щелочноземельного металла
Щелочноземельные металлы - это группа элементов, расположенная в периодической системе после щелочных металлов. Состав внешней оболочки щелочноземельного металла определяется его электронной конфигурацией.
Наиболее характерной особенностью внешней оболочки щелочноземельных металлов является наличие двух электронов в s-орбитали. Эти два электрона обеспечивают высокую химическую активность этих элементов, так как они легко участвуют в химических реакциях.
Кроме того, внешняя оболочка щелочноземельных металлов также содержит дополнительные электроны в p- и d-орбиталях. Количество этих электронов определяется атомным номером элемента и его положением в периодической системе.
Например, электронная конфигурация внешней оболочки щелочноземельного металла кальция имеет вид 4s2 4p1 4s1 4s2 3d1 4s2. Это значит, что внешняя оболочка кальция содержит 2 электрона в s-орбиталях, 1 электрон в p-орбитале и 1 электрон в d-орбитале.
Состав внешней оболочки щелочноземельного металла играет важную роль в химическом поведении элемента. Он определяет его способность образовывать ионные и ковалентные связи, а также его реакционную способность и способность образовывать соединения с другими элементами.
Электронная конфигурация щелочноземельных металлов

Щелочноземельные металлы - это элементы, расположенные во второй группе периодической системы. Внешняя электронная структура этих металлов характеризуется наличием двух электронов в s-орбиталах и общим количеством электронов, равным двум меньше, чем номер группы. Например, металлы из группы 2 имеют электронную конфигурацию s2, группы 3 - s2 p1 и так далее.
Электронные конфигурации щелочноземельных металлов обусловлены их положением в периодической системе и энергетическими уровнями электронной оболочки. Каждый следующий металл в группе имеет одно электронное зарядное ядро больше и, следовательно, внешний электрон сильнее притягивается ядром. Это приводит к увеличению энергии внешних электронов и равновесию между энергией удаления и энергией добавления электронов.
Щелочноземельные металлы имеют свойство образовывать ионные соединения с отрицательно заряженными анионами. Они отдают свои два внешних электрона, чтобы достичь стабильного октаэдрического конфигурации. Такие ионы называются катионами и обладают положительным зарядом. Из-за своей химической реактивности, щелочноземельные металлы имеют широкое применение в различных областях, включая промышленность и медицину.
- Бериллий (Be) - электронная конфигурация: [He] 2s2
- Магний (Mg) - электронная конфигурация: [Ne] 3s2
- Кальций (Ca) - электронная конфигурация: [Ar] 4s2
- Стронций (Sr) - электронная конфигурация: [Kr] 5s2
Электронная конфигурация щелочноземельных металлов определяет их химические свойства и реактивность. Взаимодействие этих металлов с другими элементами может приводить к образованию стабильных соединений, что делает их ценными реагентами в химическом синтезе и промышленности.
В заключение, электронная конфигурация щелочноземельных металлов имеет важное значение для изучения и понимания их химических свойств. Эти элементы играют важную роль в множестве процессов и реакций, и их свойства можно использовать в различных областях науки и технологий.
Атомные уровни электронной конфигурации
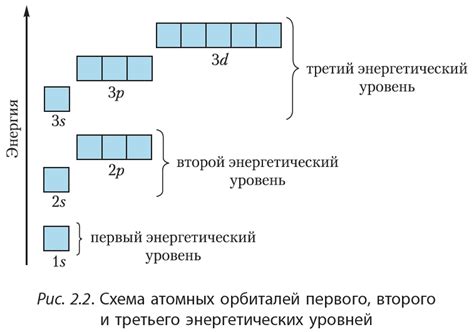
Атомные уровни электронной конфигурации - это состояния энергии, на которых находятся электроны в атоме. Каждый атом имеет набор энергетических уровней, из которых электроны могут переходить или на которых могут находиться в зависимости от своей энергии.
Электронная конфигурация щелочноземельного металла с атомными номерами 4s2, 4p1, 4s1, 4s2, 3d1, 4s2 раскрывает порядок заполнения атомных уровней. Сначала заполняется энергетический уровень 1s, затем 2s, 2p, 3s, 3p и так далее. Электроны заполняют уровни с низших энергий к высшим, а если уровень одинаковой энергии, то сначала заполняются подуровни с меньшим значением момента.
В данной конфигурации сначала заполняются уровни 1s и 2s, затем заполняются 2p орбитали, после чего происходит переход на более высокий 3d уровень. На 3d уровне находится 1 электрон. Затем электроны заполняют 4s уровень, на котором находится 2 электрона.
Атомные уровни электронной конфигурации представляют собой важные характеристики атома. Они определяют его химические свойства, взаимодействие с другими атомами и его положение в периодической системе элементов. Понимание атомных уровней электронной конфигурации помогает объяснить множество физических и химических явлений, а также проводить различные расчеты и прогнозировать поведение атома в различных ситуациях.
Химические свойства щелочноземельных металлов

1. Активность
Щелочноземельные металлы, такие как магний (Mg), кальций (Ca), стронций (Sr) и барий (Ba), обладают высокой активностью. Это связано с наличием двух электронов во внешней электронной оболочке, что делает их склонными к потере этих электронов в химических реакциях.
2. Реакция с водой
Щелочноземельные металлы реагируют с водой, образуя щелочные гидроксиды и выделяя водород. Например, магний при контакте с водой образует гидроксид магния и выделяет водородный газ.
3. Восстановительные свойства
Щелочноземельные металлы обладают сильными восстановительными свойствами, то есть они способны передавать электроны другим веществам. Это делает их полезными в процессах получения металлов из их руд, а также в различных химических реакциях.
4. Образование соединений
Щелочноземельные металлы образуют различные соединения с другими элементами. Например, магний может образовывать сплавы с алюминием, применяемые в авиационной промышленности. Кальций используется для производства цемента и стали, а стронций применяется в производстве пиротехнических составов для фейерверков.
5. Окислительные свойства
Помимо восстановительных свойств, щелочноземельные металлы также обладают окислительными свойствами. Например, барий образует окись бария, которая может окислять другие вещества. Это делает его полезным в производстве стекла и электровакуумных приборов.
Применение щелочноземельных металлов
Щелочноземельные металлы - это группа элементов в периодической таблице, которые включают бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). У всех этих элементов общая электронная конфигурация внешней оболочки, которая позволяет им образовывать стабильные и крепкие соединения с другими элементами.
Одно из основных применений щелочноземельных металлов - в производстве сплавов и легированных материалов. Бериллий, например, используется для создания сплавов с другими металлами, такими как алюминий и медь, для улучшения их механических свойств. Магний широко применяется в авиационной и автомобильной промышленности, где его легкий вес и прочность делают его идеальным материалом для конструкционных деталей.
Кроме того, щелочноземельные металлы находят применение и в области электроники и энергии. Кальций и стронций используются в производстве светящихся диодов и катодов для электронных устройств. Барий используется в производстве генераторов рентгеновского излучения и электронных вакуумных трубок. А радий, хоть и является радиоактивным элементом, имеет медицинское применение в лучевой терапии.
Щелочноземельные металлы также находят применение в сельском хозяйстве. Кальций, например, используется в качестве добавки для почвы, чтобы улучшить ее структуру и питательные свойства. Магний также широко используется в агрохимии, особенно для борьбы с дефицитом магния в почвах.
В заключение, щелочноземельные металлы играют важную роль в различных отраслях промышленности и технологий. Их уникальные свойства и возможность образовывать стабильные соединения делают их незаменимыми материалами в множестве приложений, от производства сплавов до электроники и сельского хозяйства.
Вопрос-ответ

Что такое электронная конфигурация внешней оболочки?
Электронная конфигурация внешней оболочки представляет собой расположение электронов в атоме, особенно находящихся на наиболее удаленных от ядра энергетических уровнях. Внешняя оболочка играет важную роль в химических процессах и взаимодействии атомов между собой.
Какая электронная конфигурация внешней оболочки у щелочноземельного металла?
У щелочноземельных металлов электронная конфигурация внешней оболочки имеет общий шаблон 4s2. Это означает, что у каждого атома щелочноземельного металла на внешней оболочке находятся два электрона.
Что означают цифры 4p1, 3d1 в электронной конфигурации?
Цифры 4p1 и 3d1 указывают на то, что в уровневом обозначении конфигурации на четвертом уровне находится один электрон на подуровне p, а на третьем уровне находится один электрон на подуровне d. Это означает, что в общей конфигурации атома на внешней оболочке, кроме двух электронов 4s2, есть еще один электрон 4p1 и один 3d1.
