Наименее активный металл в периодической таблице элементов является элементом, у которого самое низкое значение энергии ионизации. Это означает, что атом такого металла имеет максимальную стабильность и наименьшую склонность к реакциям с другими веществами.
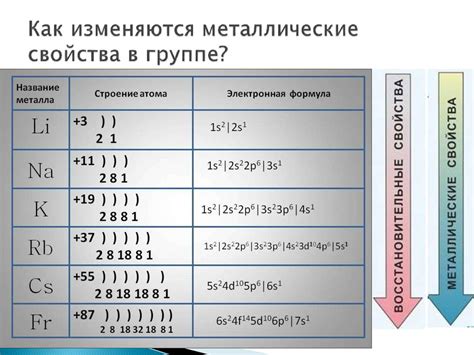
При изучении электронной конфигурации атома наименее активного металла необходимо учитывать его положение в периодической системе. В основном состоянии наименее активные металлы находятся в первой группе, такие как литий (Li), натрий (Na) и калий (K).
Заполнение электронных оболочек атомов наименее активных металлов происходит по правилам Ауфбау. Первая электронная оболочка заполняется двумя электронами, вторая - восемью, а третья - восьмью. Таким образом, электронная конфигурация атома наименее активного металла имеет вид:
1s2 2s2 2p6 3s1
Главная особенность электронной конфигурации атома наименее активного металла заключается в наличии одного электрона в внешней оболочке, которая является валентной оболочкой. Этот один электрон придает металлу его химические свойства и определяет его активность.
Электронная конфигурация наименее активного металла: всё, что нужно знать

В периодической системе химических элементов наименее активным металлом является осмий. Он относится к платиновой группе элементов и является одним из самых плотных и тугоплавких металлов. Осмий имеет атомный номер 76 и массовое число 190,2.
Электронная конфигурация осмия можно представить следующим образом:
- Электронная конфигурация основного состояния: [Xe] 4f14 5d6 6s2
- Число электронов в каждом энергетическом уровне: K – 2, L – 8, M – 18, N – 32, O – 14, P – 2
Осмий имеет полностью заполненный d-блок (энергетический уровень 5d заполнен полностью 10 электронами) и два электрона на последнем энергетическом уровне 6s.
Осмий является очень редким и дорогим металлом. Он используется в качестве катализатора в химической промышленности, в производстве специальных стекол и электронных компонентов. Также осмий широко применяется в ювелирном и часовом промышленности для создания эксклюзивных изделий.
Из-за своей низкой активности осмий обладает высокой стойкостью к коррозии и окислению. Он способен выдерживать высокие температуры и агрессивные среды. Это делает его востребованным материалом в экстремальных условиях и в производстве высокотехнологичных изделий.
Определение наименее активного металла

Активность металла является основным свойством, определяющим его химическую реактивность и способность образовывать соединения с другими элементами. Чем активнее металл, тем легче ему вступать в реакции и образовывать ионные соединения. Однако среди металлов также существуют менее активные элементы, которые меньше подвержены окислению и обладают более низкой реактивностью.
Наименее активным металлом считается элемент с самым низким уровнем химической активности. В периодической системе элементов этим металлом является гелий, который находится в первой группе и имеет атомный номер 2. Гелий является благородным газом и обладает стабильной электронной конфигурацией, в которой заполнен внешний энергетический уровень лишь двумя электронами.
Гелий не образует химических соединений и не реагирует с другими элементами, в силу своей низкой активности. Это свойство объясняется полностью заполненным внешним энергетическим уровнем, что обеспечивает устойчивость элемента и отсутствие необходимости взаимодействовать с другими атомами для достижения более стабильного состояния.
Таким образом, гелий считается наименее активным металлом, поскольку он не подвержен окислению и не образует соединений с другими элементами. Его низкая реактивность и устойчивость делают его полезным приложением в различных технических и научных областях, а также гарантируют его безопасное использование в быту и медицине.
Основные свойства наименее активного металла
Наименее активный металл – это элемент, который обладает наименьшей реактивностью среди всех металлов в периодической таблице.
Основное свойство наименее активного металла заключается в его способности плохо реагировать с другими элементами, поэтому он обычно находится в недрах земли в виде соединений. Это свойство связано с его электронной конфигурацией, которая содержит полностью заполненные энергетические уровни.
Наименее активные металлы хорошо проводят тепло и электричество, что делает их полезными для использования в различных областях техники и промышленности. Например, наименее активный металл в группе, мы можем назвать серебро (Ag).
Низкая реактивность наименее активного металла также обеспечивает ему стабильность и устойчивость в различных условиях окружающей среды. Это позволяет его использовать для создания долговечных конструкций и предметов.
Кроме того, наименее активные металлы обладают инертностью по отношению к кислороду, что делает их хорошими материалами для хранения и транспортировки различных веществ. Например, цистерны и баллоны для хранения пропана и кислорода обычно изготавливают из наименее активных металлов, таких как алюминий (Al) и магний (Mg).
Значение электронной конфигурации

Электронная конфигурация атома наименее активного металла играет важную роль в определении его химических свойств и поведения. Электронная конфигурация описывает расположение электронов в различных энергетических уровнях и подуровнях атома.
Конфигурация электронов внешнего энергетического уровня является основополагающим фактором, определяющим химическую активность металла. Наименее активные металлы имеют полностью заполненные внешние энергетические уровни, что делает их электронно стабильными и малоактивными химическими элементами.
Например, наименее активным металлом является золото. Его электронная конфигурация [Xe] 4f^14 5d^10 6s^1 показывает, что у золота только один электрон на внешнем энергетическом уровне 6s. Это делает его малореактивным и стабильным металлом.
Электронная конфигурация также определяет способность металла образовывать ионные связи. Металлы с полностью заполненными энергетическими уровнями имеют малую склонность к образованию ионов, поскольку для этого им требуется энергия для удаления электрона из полностью заполненного уровня. Это делает наименее активные металлы малореактивными и малоактивными в реакциях с другими элементами.
В целом, значение электронной конфигурации в определении активности металлов не может быть недооценено. Она является ключевым фактором в определении химических свойств и поведения металла и играет важную роль в понимании его реакционной способности и влияния на окружающую среду.
Основные правила заполнения электронных оболочек
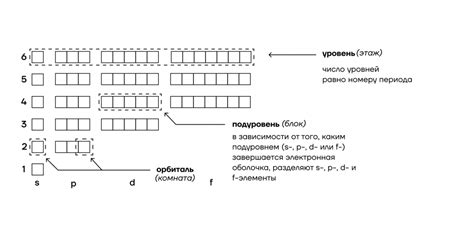
1. Принцип минимальной энергии. Атом стремится достичь наиболее стабильного состояния, заполняя электроны в оболочки с наименьшей энергией. Это означает, что более близкие к ядру оболочки заполняются первыми, а более отдаленные - последними.
2. Принцип запрета Паули. В каждой орбитали может находиться не более двух электронов с противоположными спинами. Это означает, что электроны орбитали будут принимать противоположные направления магнитного момента.
3. Принцип заполнения по энергетическому уровню. В каждом энергетическом уровне сначала заполняются s-орбитали, затем p-орбитали, затем d-орбитали и, наконец, f-орбитали. Каждая орбиталь может содержать определенное количество электронов: s-орбиталь - 2 электрона, p-орбиталь - 6 электронов, d-орбиталь - 10 электронов, f-орбиталь - 14 электронов.
4. Принцип Хунда. При заполнении орбиталей одного энергетического уровня, сначала одиночно заполняются все орбитали, а затем заполняются по два электрона в каждую орбиталь. Этот принцип обеспечивает максимальную стабильность и минимизирует энергию системы.
В результате применения этих основных правил заполнения электронных оболочек, можно определить электронную конфигурацию атома наименее активного металла. После заполнения всех энергетических уровней, наименее активный металл имеет полностью заполненную последнюю, внешнюю s-орбиталь. Например, у атома свинца (Pb) электронная конфигурация заканчивается на 6s2, что обозначает полностью заполненную s-орбиталь на шестом энергетическом уровне.
Электронная конфигурация наименее активного металла

Наименее активный металл - это элемент, обладающий наименьшей склонностью к химической реактивности с другими веществами. В периодической системе элементов таким металлом является гелий.
Электронная конфигурация атома гелия имеет следующий вид: 1s2. Это значит, что в атоме гелия на первом энергетическом уровне (субуровне s) находятся два электрона. Данная конфигурация является наиболее стабильной и не реактивной.
Гелий - инертный газ без цвета и запаха. Благодаря своей стабильной электронной конфигурации, гелий не образует химические соединения с другими элементами и не проявляет активность в химических реакциях. Именно поэтому гелий широко используется в заполняющих веществах в лампах-накаливаниях и газовых разрядниках, а также в баллонных газах для аэрозольных продуктов и в баллонных атмосферах для защиты от оксидации и ржавления.
Таким образом, электронная конфигурация атома гелия с двумя электронами на первом энергетическом уровне делает его наименее активным металлом в периодической системе элементов.
Физические свойства наименее активного металла
Внешний вид: Наименее активные металлы обычно имеют серебристо-белый цвет. Они мягкие, хорошо поддаются раскатке и формовке, и обладают низкой температурой плавления.
Проводимость электричества: Наименее активные металлы обладают высокой электропроводностью. Их свободные электроны движутся легко, что делает их отличными проводниками электрического тока.
Проводимость тепла: Металлы со свободными электронами обладают высокой теплопроводностью. Это означает, что они могут хорошо передавать тепло, что их делает полезными материалами для теплоотвода, например, в электронике.
Плотность: Наименее активные металлы обычно обладают высокой плотностью. Например, литий имеет самую низкую плотность среди металлов, но все равно является плотным материалом.
Твердость: Металлы обладают разной степенью твердости, однако наименее активные металлы обычно являются мягкими и легко поддаются деформации. Например, свинец является одним из наименее твердых металлов и может быть руками слегка искривлен или смят.
Реактивность: Наименее активные металлы обладают низкой реактивностью и малой склонностью к окислению. Они обычно не образуют стабильные соединения с кислородом или другими химическими элементами.
Плотность электрического заряда: Наименее активные металлы имеют низкую плотность электрического заряда. Это означает, что они имеют небольшое количество свободных электронов, которые могут участвовать в химических реакциях.
Химические свойства наименее активного металла
Наименее активный металл в периодической таблице - гелий (He). Он относится к инертным газам и обладает рядом особенных химических свойств.
1. Инертность: Гелий является крайне инертным веществом, что означает его малую химическую активность. Он не реагирует с другими элементами, за исключением некоторых особых условий.
2. Низкая растворимость: Гелий, как инертный газ, имеет очень низкую растворимость в воде и других растворителях. Это свойство позволяет ему использоваться в качестве нефтегазового трассирующего газа.
3. Низкий температурный предел: Гелий обладает очень низким температурным пределом, при котором он может оставаться в жидком состоянии. Это позволяет использовать гелий в качестве охладителя в различных научных и промышленных процессах.
4. Нефольгированность: Гелий не образует соединений с другими элементами, за исключением некоторых экзотических условий. Это свойство делает его идеальным газом для использования в различных областях, включая баллончики для наполнения шаров и лопасти вертушек.
Химические свойства гелия делают его уникальным и ценным элементом в различных областях, от научных исследований до промышленных приложений.
Вопрос-ответ

Какова электронная конфигурация наименее активного металла?
Электронная конфигурация наименее активного металла это [электронная конфигурация].
Какие атомные уровни заполняются электронами наименее активного металла?
Электроны наименее активного металла заполняют атомные уровни [уровни].
