Электронная конфигурация ионов металлов – это упорядоченное распределение электронов по энергетическим уровням и подуровням атома металла в ионном состоянии. Электронная конфигурация определяет химические и физические свойства ионов металлов, такие как магнитные, электрические и тепловые свойства, устойчивость и химическую активность.
Особенностью электронной конфигурации ионов металлов является то, что они имеют неполностью заполненные энергетические уровни, что делает их более активными и способными образовывать соединения с другими элементами. Кроме того, электронная конфигурация ионов металлов может изменяться при образовании положительно или отрицательно заряженных ионов, что также влияет на их свойства.
Примерами электронной конфигурации ионов металлов являются ионы железа, меди, цинка, свинца и др. Например, ионы железа могут иметь электронную конфигурацию Fe2+ - [Ar] 3d6, Fe3+ - [Ar] 3d5. Ионы меди могут иметь электронную конфигурацию Cu+ - [Ar] 3d10, Cu2+ - [Ar] 3d9. Ионы цинка могут иметь электронную конфигурацию Zn2+ - [Ar] 3d10. Ионы свинца могут иметь электронную конфигурацию Pb2+ - [Xe] 4f14 5d10 6s2 6p0.
Знание электронной конфигурации ионов металлов позволяет составлять уравнения реакций, определять способность металла образовывать ионы различных зарядов, предсказывать его химические свойства и взаимодействия с другими веществами. Таким образом, изучение электронной конфигурации ионов металлов является важным аспектом химической науки и имеет практическое применение в различных областях, включая материаловедение, аналитическую и органическую химию.
Что такое электронная конфигурация?
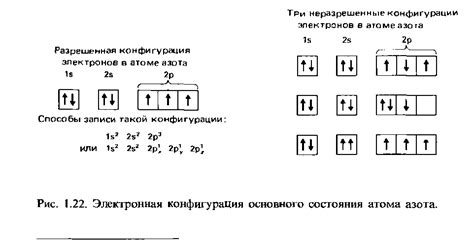
Электронная конфигурация - это упорядоченное распределение электронов по энергетическим уровням и подуровням вокруг ядра атома. Она описывает, как электроны заполняют энергетические уровни в атоме и определяет его химические свойства.
Электронная конфигурация записывается с использованием символов элементов и чисел, обозначающих количество электронов на каждом уровне и подуровне. Например, для атома кислорода (О) электронная конфигурация будет выглядеть как 1s^2 2s^2 2p^4, где цифры указывают количество электронов на каждом субуровне, а буквы s и p обозначают типы подуровней в атоме.
Электронная конфигурация играет важную роль в определении химических свойств элементов и их возможности образовывать химические связи. В зависимости от электронной конфигурации атом может быть стабильным или нестабильным, а его внешние электроны могут участвовать в химических реакциях или оставаться неподвижными.
Значение электронной конфигурации ионов металлов
Электронная конфигурация ионов металлов играет важную роль в определении химических и физических свойств этих элементов. Когда металлы образуют ионы, они теряют или получают электроны, что приводит к изменению конфигурации электронной оболочки. Эти изменения влияют на способность металлов взаимодействовать с другими веществами и их электрохимическую активность.
Ионы металлов имеют обычно положительный заряд, так как они теряют один или несколько электронов со своей внешней оболочки. Их электронная конфигурация указывает на количество потерянных или полученных электронов и определяет, как они взаимодействуют с другими ионами и молекулами.
Например, ионы железа Fe2+ и Fe3+ имеют различные электронные конфигурации. В ионе Fe2+ теряется два электрона, поэтому электронная конфигурация становится [Ar] 3d6. В случае иона Fe3+ теряется три электрона, и его электронная конфигурация становится [Ar] 3d5. Это изменение в электронной конфигурации влияет на способность железа взаимодействовать с другими атомами и молекулами, что имеет большое значение в химических реакциях, в которых участвуют ионы Fe2+ и Fe3+.
Электронная конфигурация ионов металлов также может влиять на их физические свойства, такие как теплоемкость, плотность и теплопроводность. Например, изменение электронной конфигурации в ионах металлов может привести к изменению их способности проводить электричество или тепло. Это может иметь практическое применение в различных областях, включая электронику, энергетику и материаловедение.
Особенности электронной конфигурации ионов металлов
1. Ионизация ведет к изменению электронной конфигурации металлов.
Одной из особенностей металлов является их способность образовывать ионы путем потери электронов. Когда металл переходит в ионное состояние, его электронная конфигурация изменяется. Это связано с потерей или приобретением электронов, что приводит к изменению расположения электронов на энергетических уровнях.
2. Ионизация металлов связана с образованием положительно заряженных ионов.
Металлы имеют тенденцию потерять электроны, образуя положительно заряженные ионы. Это происходит из-за их низкой электроотрицательности и способности отдавать электроны из внешних энергетических уровней, чтобы достичь стабильной конфигурации. Например, ион железа Fe^2+ образуется из атома железа Fe путем потери двух электронов.
3. Образование ионов металлов обусловлено положительным зарядом ядра.
Металлы имеют характерное строение, где внешняя электронная оболочка слабо удерживается ядром. Из-за сильного объемного эффекта положительно заряженного ядра, электроны находятся в слабом взаимодействии с ядром и могут легко отдаваться. Это приводит к образованию положительно заряженных ионов металлов.
4. Электронная конфигурация ионов металлов влияет на их химические свойства и реакционную способность.
Электронная конфигурация ионов металлов определяет их химические свойства и реакционную способность. Наличие большого числа внешних электронов у положительно заряженных ионов металлов способствует их взаимодействию с отрицательно заряженными частицами или молекулами, что позволяет им образовывать соединения.
5. Взаимодействие ионов металлов определяет их способность образовывать кристаллические решетки.
Ионы металлов взаимодействуют друг с другом, образуя кристаллические решетки. При этом электронные облака ионов перекрываются, образуя сильные металлические связи, что позволяет металлам обладать хорошей проводимостью электричества и тепла, а также образовывать кристаллы с определенными планарными структурами.
Как определить электронную конфигурацию ионов металлов?

Электронная конфигурация ионов металлов может быть определена на основе знания электронной конфигурации атомов металлов и их основных свойств. Ионы металлов могут иметь положительный заряд, они образуются путем потери одного или нескольких электронов. Таким образом, для определения электронной конфигурации ионов металлов необходимо знать электронную конфигурацию атомов металлов и количество потерянных электронов.
Электронная конфигурация ионов металлов может быть представлена в виде химической формулы или обозначена с помощью арабских цифр и символов элементов. Например, для иона железа Fe^2+ электронная конфигурация будет обозначаться как [Ar] 3d^6, где [Ar] обозначает электронную конфигурацию атома аргона, а 3d^6 - электронная конфигурация оставшихся электронов. В случае, когда ион имеет положительный заряд, количество электронов в электронной оболочке уменьшается.
Ионные радиусы металлов также играют важную роль в определении их электронной конфигурации. Увеличение положительного заряда иона металла влечет за собой уменьшение его ионного радиуса, что может влиять на распределение электронов в электронных оболочках. Ионный радиус ионов металлов может быть определен с помощью периодической системы элементов.
Определение электронной конфигурации ионов металлов является важной задачей в химии и имеет широкое практическое применение. Знание электронной конфигурации ионов помогает понять и предсказать их химические свойства, реактивность и способность образовывать соединения с другими элементами. Ионные соединения металлов широко используются в различных областях, таких как промышленность, электроника, медицина и другие.
Примеры электронной конфигурации ионов металлов
Электронная конфигурация ионы металлов может иметь различные особенности в зависимости от их валентности. Некоторые примеры таких ионов можно привести:
1. Ионы металлов с постоянной валентностью:
Например, ион Fe2+ имеет электронную конфигурацию [Ar] 3d6, а ион Fe3+ имеет электронную конфигурацию [Ar] 3d5. В обоих случаях конфигурация образуется путем заполнения подуровней d-орбиталей.
2. Ионы металлов с переменной валентностью:
Например, ионы железа Fe могут иметь различную валентность в соединениях. Например, в ионе Fe2O3 железо имеет валентность +3, а в ионе FeO - +2. Это обусловлено переходом электронов между d-орбиталями. Электронная конфигурация ионов Fe3+ и Fe2+ также отличается.
3. Ионные продукты расщепления:
Некоторые металлы, такие как калий K, имеют свойство образовывать только один тип иона - K+. Электронная конфигурация ионов K+ состоит из недавно сформированного октета (2s2 2p6), что делает его стабильным.
4. Ионы транзиционных металлов:
Ионы транзиционных металлов, таких как медь Cu, имеют сложную электронную конфигурацию из-за заполнения d-орбиталей. Например, ион Cu+ имеет электронную конфигурацию [Ar] 3d10, а ион Cu2+ - [Ar] 3d9.
Таким образом, электронная конфигурация ионов металлов имеет свои особенности и может зависеть от валентности и типа металла.
Значение электронной конфигурации металлических ионов для свойств вещества
Электронная конфигурация металлических ионов играет важную роль в определении свойств вещества. Ионы металлов, образуемые при потере или приобретении электронов, имеют особую структуру, которая влияет на их химическую активность, физические свойства и способность к образованию соединений.
Именно изменение электронной конфигурации при образовании ионов металлов позволяет им приобретать стабильность и достигать определенного числа внешних электронов в основной энергетической оболочке. В результате этого процесса металлические ионы могут продемонстрировать ряд свойств, включая металлический блеск, теплопроводность, электропроводность и пластичность.
Например, электронная конфигурация иона железа Fe2+ (1s^2 2s^2 2p^6 3s^2 3p^6 3d^6) говорит о наличии 6 валентных электронов в d-оболочке, что определяет его способность образовывать соединения с соединительной степенью 3+. Подобные ионы обладают высокой химической активностью и способностью вступать в реакции с различными соединениями.
Электронная конфигурация ионов металлов также определяет их магнитные свойства. Например, ионы железа Fe2+ и Fe3+ обладают различными магнитными моментами из-за своей разной электронной структуры. Это позволяет использовать эти ионы в промышленности для создания магнитных материалов и устройств.
Таким образом, электронная конфигурация металлических ионов играет критическую роль в определении свойств вещества. Она определяет их химическую активность, физические свойства, магнитные свойства и способность к образованию соединений. Изучение этих свойств и их зависимости от электронной конфигурации позволяет лучше понять поведение металлических ионов и разрабатывать новые материалы с определенными свойствами.
Вопрос-ответ

Какие особенности электронной конфигурации ионов металлов?
Особенности электронной конфигурации ионов металлов включают в себя изменение количества электронов в оболочках, что приводит к образованию заряда ионов. Также стоит отметить, что у ионов металлов электронная конфигурация может быть устойчивой или неустойчивой в зависимости от количества электронов.
Как изменяется электронная конфигурация ионов металлов при образовании положительного иона?
При образовании положительного иона, электронная конфигурация металла изменяется путем потери одного или нескольких электронов из внешней оболочки. Это приводит к уменьшению количества электронов в оболочке и образованию положительного заряда иона. Например, натрий (Na) имеет электронную конфигурацию 2, 8, 1, а его положительный ион (Na+) имеет конфигурацию 2, 8.
Как изменяется электронная конфигурация ионов металлов при образовании отрицательного иона?
При образовании отрицательного иона, электронная конфигурация металла изменяется путем получения одного или нескольких электронов во внешнюю оболочку. Это приводит к увеличению количества электронов в оболочке и образованию отрицательного заряда иона. Например, хлор (Cl) имеет электронную конфигурацию 2, 8, 7, а его отрицательный ион (Cl-) имеет конфигурацию 2, 8, 8.
Какие примеры можно привести электронной конфигурации ионов металлов?
Примеры электронной конфигурации ионов металлов включают в себя железо (Fe), которое имеет электронную конфигурацию 1s2 2s2 2p6 3s2 3p6 4s2 3d6. При образовании положительного иона железа (Fe2+) конфигурация будет 1s2 2s2 2p6 3s2 3p6 3d6, а при образовании положительного иона железа (Fe3+) конфигурация будет 1s2 2s2 2p6 3s2 3p6 3d5. Также можно привести пример меди (Cu), у которой электронная конфигурация равна 1s2 2s2 2p6 3s2 3p6 4s1 3d10, а образование положительного иона (Cu2+) приведет к конфигурации 1s2 2s2 2p6 3s2 3p6 3d9.
