Натрий - это один из наиболее активных металлов, который относится к периодической таблице элементов. Его атомный номер - 11. Натрий, обладая одной внешней электронной оболочкой, является атомом, который легко теряет эту электронную оболочку, чтобы стать положительным ионом.
Электронная конфигурация натрия можно записать как [Ne] 3s1. Здесь [Ne] представляет электронную конфигурацию аргона, предыдущего элемента в таблице, который имеет законченную внешнюю электронную оболочку. Натрий имеет одного электрона в внешней оболочке 3s, который легко может быть передан другим атомам во время химических реакций.
Будучи наиболее активным металлом, натрий обладает высокой реактивностью. Он легко реагирует с кислородом воздуха, образуя оксид натрия. Также он реагирует с водородом, образуя гидроксид натрия и выделяя водород. Натрий также реагирует с большинством неметаллов и множеством других соединений. Его активность обусловлена наличием одного электрона во внешней оболочке, который легко теряется.
Короче говоря, электронная конфигурация натрия [Ne] 3s1 делает его наиболее активным металлом в периодической таблице элементов. Благодаря своей высокой реактивности, натрий находит широкое применение в различных областях, включая производство промышленных и бытовых товаров, медицину и пищевую промышленность.
Электронная конфигурация металла - залог его активности

Электронная конфигурация металла является важным аспектом, определяющим его активность и химические свойства. Электронная конфигурация представляет собой распределение электронов в энергетических уровнях атома металла.
Металлы, обладающие неполностью заполненными энергетическими уровнями, обычно обладают высокой активностью. Это связано с тем, что неполностью заполненные энергетические уровни стремятся завершить свою электронную конфигурацию путем взаимодействия с другими атомами.
Наиболее активным металлом является стронций (Sr), у которого электронная конфигурация имеет вид 5s^2. Это означает, что у атома стронция в его неполностью заполненном энергетическом уровне находятся 2 электрона. Благодаря этому, стронций обладает высокой реакционной способностью и легко взаимодействует с другими элементами.
Другими активными металлами являются, например, натрий (Na) и калий (K). У натрия электронная конфигурация 3s^1, а у калия 4s^1. Оба этих элемента имеют неполностью заполненные энергетические уровни и легко вступают в реакции с водой и кислородом.
В целом, электронная конфигурация металла играет важную роль в определении его активности и способности вступать в химические реакции. Чем более неполностью заполненными энергетическими уровнями обладает атом металла, тем выше его активность.
Металл - основа современной промышленности

Металл, как основа современной промышленности, играет важную роль в различных отраслях экономики. Эти твердые, обычно глянцевые и прекрасно проводящие тепло и электричество материалы обладают уникальными физическими и химическими свойствами, которые делают их неотъемлемой частью большинства процессов производства и производства многих продуктов.
Металлы используются во множестве отраслей, включая строительство, машиностроение, автомобильную промышленность, энергетику и многие другие. Они служат основой для создания конструкций, машин и инструментов, а также для производства кабелей, проводов, электроники и других электротехнических устройств.
Одной из важнейших характеристик металлов является их электронная конфигурация. Большинство металлов имеют низкую энергию ионизации, что означает, что их внешний электрон легко отдаётся, образуя положительные ионы. Это делает металлы хорошими проводниками электричества и тепла.
Некоторые из самых активных металлов в периодической системе, такие как литий, натрий и калий, имеют наиболее низкую электронную конфигурацию. Они обладают всего одним электроном на внешнем энергетическом уровне, который легко отдается другим атомам. Именно поэтому они обладают высокой реактивностью и используются, например, в производстве аккумуляторов и пищевой соли.
Металлы важны и для экологии. Из-за своей прочности и стабильности, они используются в строительстве зданий и мостов, что дает им долгий срок службы и снижает потребность в ремонте и замене. Металлы также могут быть переработаны и вторично использованы, что помогает снизить количество отходов и сохранить природные ресурсы.
Роль электронной конфигурации в свойствах металла
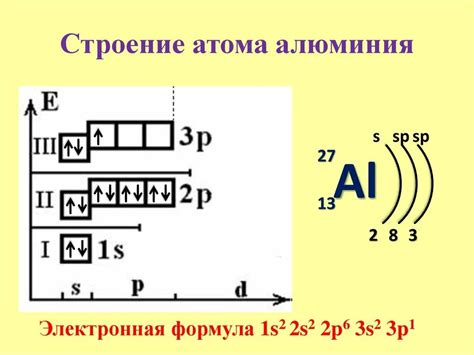
Электронная конфигурация влияет на свойства металлов и определяет их химическую активность, электроны внешней оболочки играют важную роль во многих химических процессах. Металлы обычно имеют малое число электронов во внешней оболочке, что делает их более склонными к потере электронов и образованию положительно заряженных ионов.
Металлы с полностью заполненной внешней оболочкой обладают высокой стойкостью и низкой реактивностью. Например, металлы группы 12 - цинк (Zn), кадмий (Cd) и ртуть (Hg) имеют электронную конфигурацию, в которой внешняя s-подобная оболочка полностью заполнена. Это делает их менее активными в химических реакциях по сравнению с другими металлами.
С другой стороны, металлы групп 1 и 2 (щелочные и щелочноземельные металлы) имеют один или два электрона во внешней оболочке, что делает их очень реактивными. Эти металлы легко отдают электроны и образуют положительно заряженные ионы. Например, натрий (Na) и калий (K), имеющие один электрон во внешней оболочке, реагируют с водой, выделяя водород и образуя гидроксид натрия и гидроксид калия соответственно.
Таким образом, электронная конфигурация определяет химическую активность металла и его способность образовывать соединения. Больше электронов во внешней оболочке металла, меньше его химическая активность, и наоборот. Это позволяет использовать металлы в различных областях, таких как промышленность, наука и технологии.
Наиболее активный металл и его электронная конфигурация
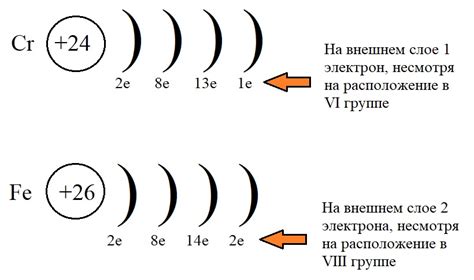
Наиболее активным металлом в периодической системе является флюор. Его атомный номер равен 9, а атомный вес примерно равен 19. Он относится к группе 1 и периоду 2, что делает его химическим элементом первого периода и первой группы. Флюор имеет одну электронную оболочку, в которой находятся два электрона.
Электронная конфигурация флюора записывается как 1s2 2s2 2p5. Это означает, что первая энергетическая оболочка содержит два электрона, вторая оболочка содержит два электрона на подуровне s и пять электронов на подуровне p.
Из-за своей высокой реактивности, флюор является одним из самых активных металлов. Он легко образует соединения с другими элементами, особенно неметаллами, и может проявлять высокую степень химической активности. Эта активность основана на том, что флюор стремится достичь электронной конфигурации газообразного неона, добавляя или отдавая электроны, чтобы заполнить свою последнюю энергетическую оболочку.
Электронная конфигурация флюора и его высокая активность делают его полезным элементом для различных применений, включая производство химических соединений, а также в научных исследованиях. Флюор является важным компонентом многих минералов и минеральных видов, таких как флюорит, который широко используется в промышленности и ювелирном деле.
В заключение, флюор, наиболее активный металл в периодической системе, имеет электронную конфигурацию 1s2 2s2 2p5, и из-за своей активности он может легко вступать в химические реакции и образовывать соединения с другими элементами.
Вопрос-ответ

Какая электронная конфигурация у наиболее активного металла?
Наиболее активным металлом является франций (Fr), у которого электронная конфигурация: [Rn] 7s1. Внешним электроном в его электронной оболочке является один электрон s-подуровня.
Что такое электронная конфигурация?
Электронная конфигурация - это распределение электронов в атоме, описывающее их наиболее вероятное местоположение в атоме. Она представляет собой запись, в которой указывается, сколько электронов находится на каждом энергетическом уровне и орбитале.
Какие еще металлы считаются активными?
Кроме франция, активными металлами считаются калий (K), натрий (Na), цезий (Cs) и литий (Li). Их электронные конфигурации соответственно: [Ar] 4s1, [Ne] 3s1, [Xe] 6s1 и [He] 2s1. У этих металлов тоже один внешний электрон на s-подуровне.
Влияет ли электронная конфигурация на активность металла?
Да, электронная конфигурация влияет на активность металла. Большинство металлов стараются достичь стабильной электронной конфигурации, наподобие электронной конфигурации благородных газов (с заполненной внешней энергетической оболочкой). Поэтому активные металлы имеют меньше электронов в своей внешней оболочке и готовы отдавать их при взаимодействии с другими веществами.
Какие свойства делают металл активным?
Активные металлы обладают такими свойствами, как высокая реакционная способность, способность легко отдавать электроны и образовывать ионы положительной заряды, низкая энергия ионизации и электроотрицательность. Эти характеристики делают металлы активными в химических реакциях.
