Электронная конфигурация 3d64s2 - это электронная конфигурация некоторых химических элементов, таких как аргон, железо, криптон и рутений. Эта конфигурация указывает на расположение электронов в атоме. 3d обозначает, что эти электроны находятся на третьем энергетическом уровне, а 4s2 - на четвертом уровне.
Аргон (Ar) имеет атомный номер 18 и принадлежит к группе инертных газов. Его электронная конфигурация 3d64s2 указывает на то, что в его атоме есть 18 электронов. Внешний энергетический уровень атома аргона заполнен, что делает его стабильным и малоактивным химическим элементом.
Железо (Fe) - химический элемент с атомным номером 26. Его электронная конфигурация 3d64s2 указывает на наличие 26 электронов. Железо является переходным металлом и имеет разнообразные химические свойства. Его внешний энергетический уровень не полностью заполнен, поэтому оно может образовывать соединения с другими элементами.
Криптон (Kr) - очень редкий инертный газ с атомным номером 36. Его электронная конфигурация 3d64s2 указывает на то, что в его атоме есть 36 электронов. Криптон также является стабильным химическим элементом благодаря полностью заполненному внешнему энергетическому уровню.
Рутений (Ru) - переходный металл с атомным номером 44. Его электронная конфигурация 3d64s2 указывает на наличие 44 электронов. Рутений имеет разнообразные химические свойства, так как его внешний энергетический уровень не полностью заполнен. Этот элемент также является благородным металлом и используется в различных промышленных процессах и катализаторах.
Электронная конфигурация атома аргона

Электронная конфигурация атома аргона — это распределение электронов в его электронных оболочках. Аргон (Ar) имеет атомный номер 18 и принадлежит к группе инертных газов. Этот элемент имеет следующую электронную конфигурацию: 1s2 2s2 2p6 3s2 3p6.
Атомный радиус аргона составляет около 97 пикометров, что делает его достаточно крупным элементом. Аргон является безвредным газом, не имеющим цвета и запаха. Он находится в атмосфере Земли в очень небольших количествах, около 0,93% общего объема атмосферы.
Аргон проявляет особенности, связанные с его электронной конфигурацией. Благодаря полностью заполненным энергетическим уровням, аргон является инертным газом и не образует химические соединения с другими элементами. Это свойство делает аргоны невоспламеняемым и безопасным для использования в окружающей среде.
Электронная конфигурация аргона позволяет нам лучше понять его химические свойства. Она указывает на наличие полностью заполненной трехмерной 3p-оболочки и пятисоставной 3d-оболочки, которая является частично заполненной. Это может быть важным фактором при изучении и использовании аргона в различных отраслях, включая освещение, сварку и электронику.
Электронная конфигурация атома железа
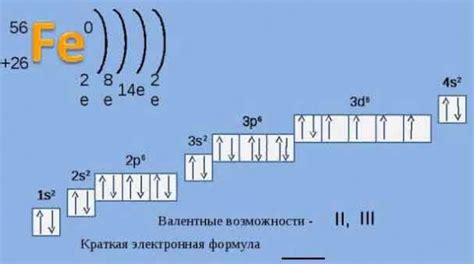
Железо является химическим элементом с атомным номером 26. Его электронная конфигурация представляет собой распределение электронов по энергетическим уровням и субуровням в атоме железа.
Атом железа имеет электронную конфигурацию 1s2 2s2 2p6 3s2 3p6 3d6 4s2. Это обозначает, что внутренние энергетические уровни заполнены электронами в следующем порядке: 1s2, 2s2, 2p6, 3s2, 3p6. Остальные электроны распределяются на субуровнях 3d и 4s.
На субуровне 3d находятся 6 электронов. Правило Хунда гласит, что электроны заполняют все доступные орбитали одного энергетического уровня, прежде чем начать заполнять орбитали более высокого уровня. Следовательно, электроны заполняют сначала 3d, а затем 4s.
Субуровень 4s содержит 2 электрона. Таким образом, электронная конфигурация железа можно записать как [Ar] 3d6 4s2, где [Ar] обозначает атом аргона, электронная конфигурация которого заканчивается на 3p6.
Электронная конфигурация железа описывает распределение его электронов на энергетических уровнях и помогает предсказать его химические свойства. Знание электронной конфигурации также полезно для понимания взаимодействия железа с другими элементами и соединениями.
Электронная конфигурация атома криптона

Атом криптона, символ Kr, является элементом с атомным номером 36 в периодической системе элементов. Его электронная конфигурация состоит из 36 электронов, распределенных по энергетическим уровням и подуровням атома.
Электронная конфигурация криптона можно представить следующим образом:
- 1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p67s25f146d107p6
Это означает, что у криптона есть два электрона на внешнем энергетическом уровне (7s2), которые являются валентными электронами, и образуют основу его химических свойств. Криптон относится к группе инертных газов, так как его внешний энергетический уровень полностью заполнен, и он достигает электронной стабильности.
Криптон является безцветным инертным газом, обладает высокой плотностью и используется в различных технических и научных областях. Также он используется в рентгеновских и лазерных технологиях, а его способность светиться при высоких напряжениях делает его полезным в рекламе и освещении.
Электронная конфигурация атома рутения
Атом рутения (Ru) имеет атомный номер 44 и находится в периоде 5, группе 8 периодической системы элементов. Его электронная конфигурация может быть записана как [Kr] 4d^7 5s^1.
Первый энергетический уровень, представленный благодаря конфигурации [Kr], содержит 18 электронов и состоит из замкнутого объема силовых оболочек. Второй энергетический уровень, обозначенный 4d, включает в себя 7 электронов, а третий уровень, обозначенный 5s, содержит 1 электрон.
Таким образом, электронная конфигурация атома рутения состоит из 2 энергетических уровней и наиболее заполненной оболочки 4d, которая содержит 7 электронов. Это делает рутений переходным металлом и позволяет ему образовывать разнообразные соединения с другими элементами.
Атомы рутения имеют тенденцию образовывать два ионных состояния: Ru^2+ и Ru^3+. Потеря двух или трех электронов соответственно позволяет рутению достичь стабильной электронной конфигурации аргона или криптона.
Электронная конфигурация атома рутения может быть использована для объяснения его химических свойств и реактивности, а также для предсказания его реакций с другими элементами. Эта информация имеет важное значение в изучении различных аспектов рутения, включая его применение в промышленности и научных исследованиях.
Составление электронной конфигурации 3d64s2

Электронная конфигурация элементов определяет расположение электронов в их атомах. Для составления электронной конфигурации 3d64s2 необходимо знать, что данная конфигурация относится к атомам элементов аргон, железо, криптон и рутений.
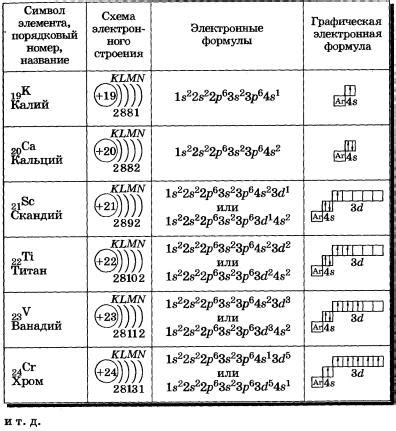
Элемент аргон (Ar) имеет атомный номер 18 и относится к группе благородных газов. Его электронная конфигурация состоит из трех уровней энергии: первый уровень заполнен полностью с двуми электронами, второй уровень также заполнен полностью с восьмью электронами, а третий уровень заполнен восемью электронами, из которых шесть находятся на подуровне 2p и два - на подуровне 3s.
Железо (Fe) имеет атомный номер 26 и относится к переходным металлам. Его электронная конфигурация начинается с такой же конфигурации, как у аргона, но затем на подуровне 3d дополнительно располагается восемь электронов, а на подуровне 4s - два электрона. Таким образом, электронная конфигурация железа будет 1s2 2s2 2p6 3s2 3p6 3d6 4s2.
Криптон (Kr) имеет атомный номер 36 и относится к благородным газам. Его электронная конфигурация начинается также с конфигурации аргона, но на подуровне 4s располагаются два электрона, а на подуровне 3d - шесть электронов. Таким образом, электронная конфигурация криптона будет 1s2 2s2 2p6 3s2 3p6 4s2 3d10.
Рутений (Ru) имеет атомный номер 44 и также относится к переходным металлам. Его электронная конфигурация начинается с аргона, затем на подуровне 4s находятся два электрона, а на подуровне 3d - десять электронов. В итоге, электронная конфигурация рутения будет 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d6.
Особенности электронной конфигурации атомов аргона, железа, криптона и рутения
Аргон: Атом аргона имеет электронную конфигурацию 3d64s2, что означает, что у него есть 3 электрона в оболочке d и 2 электрона в оболочке s. Это инертный элемент с полностью заполненной внешней оболочкой, что делает его стабильным и малоактивным химическим элементом. Инертность аргона связана с орбитальной стабилизацией, которая достигается благодаря полному заполнению всех 2s и 2p энергетических уровней.
Железо: Электронная конфигурация атома железа состоит из 3d64s2. Это означает, что у него есть 6 электронов в оболочке d и 2 электрона в оболочке s. Железо является переходным металлом с промежуточными свойствами между металлами и неметаллами. Это связано с наличием неполной оболочки d-электронов, которая позволяет железу образовывать различные химические соединения и проявлять каталитическую активность.
Криптон: Атом криптона имеет электронную конфигурацию 3d64s2. Он имеет полностью заполненные оболочки электронов и является инертным газом. Криптон применяется в различных технических и научных областях, включая осветительную технику, лазеры и измерения радиоактивности.
Рутений: Электронная конфигурация атома рутения состоит из 3d64s2. У него есть 6 электронов в оболочке d и 2 электрона в оболочке s. Рутений является переходным металлом и имеет множество применений, включая катализаторы в химической промышленности, магнитные материалы и использование в ювелирных изделиях.
Роль электронной конфигурации в химических свойствах аргона, железа, криптона и рутения

Аргон:
Электронная конфигурация аргона состоит из шести электронов в п-оболочке и восьми электронов в s-оболочке. Это полностью заполненные энергетические уровни. Благодаря этой конфигурации аргон является инертным газом и практически не участвует в химических реакциях. Аргон обладает высокой стабильностью и неподвижностью, что делает его идеальным для использования в различных процессах, таких как сварка и смешивание газов.
Железо:
Электронная конфигурация железа состоит из электронов, размещенных в трех оболочках: двух в 1s, восьми в 2s и 2p, восемнадцати в 3s и 3p, а также шести в 3d-оболочке. Последние два электрона в 3d-оболочке придают железу особые химические свойства. Железо является характерным переходным металлом, способным образовывать различные оксиды, соли и координационные соединения. Благодаря своей электронной конфигурации, железо является не только одним из самых распространенных металлов на Земле, но и имеет большое применение в промышленности.
Криптон:
Электронная конфигурация криптона состоит из шести электронов в п-оболочке, двух в s-оболочке и 32 в d-оболочке. Полностью заполненные p- и s-оболочки придают криптону стабильность, что делает его инертным газом. Это означает, что криптон почти не участвует в химических реакциях и не образует соединений с другими элементами. Вместо этого он находит широкое применение в осветительной промышленности, например, в лазерных технологиях и высокоэффективных светильниках.
Рутений:
Электронная конфигурация рутения состоит из двух электронов в 1s, восьми электронов в 2s и 2p, восемнадцати электронов в 3s и 3p и сорока двух электронов в 4s, 3d и 4p. Благодаря своей электронной конфигурации, рутений обладает химической активностью и может образовывать соединения с другими элементами. Рутений используется в различных областях, таких как катализаторы, электроды и сплавы. Он также имеет важное применение в медицине, например, в радиотерапии и лечении рака.
Вопрос-ответ

Какова электронная конфигурация атома аргона?
Электронная конфигурация атома аргона: 1s2 2s2 2p6 3s2 3p6. В общей сложности у аргона 18 электронов.
Какова электронная конфигурация атома железа?
Электронная конфигурация атома железа может варьироваться в различных степенях окисления. Наиболее стабильной электронной конфигурацией железа является: [Ar] 3d6 4s2.
Сколько электронов есть в атоме криптона?
Электронная конфигурация атома криптона: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6. Таким образом, у криптона содержится 36 электронов.
Что означает электронная конфигурация атома рутения?
Электронная конфигурация атома рутения: [Kr] 5s2 4d6. Здесь [Kr] обозначает выполнение электронной конфигурации атома рутения по правилам аргона (завершение электронной конфигурации перед переходом на следующую энергетическую оболочку).
Каково расположение электронов в оболочках атома рутения?
В атоме рутения наиболее стабильной электронной конфигурацией является [Kr] 5s2 4d6. Это означает, что первые два электрона располагаются на 5s-орбитале, а следующие шесть электронов занимают 4d-орбитали.
