Атомы щелочноземельных металлов, таких как бериллий, магний, кальций, стронций и барий, имеют свою особенную электронную формулу энергетического уровня. Эта формула показывает распределение электронов вокруг ядра атома и определяет его химические свойства и способность образовывать соединения.
На самом низшем энергетическом уровне атомов щелочноземельных металлов находится 2 электрона. Они обозначаются символами 1s^2. Важно отметить, что эти электроны находятся в s-орбиталях, которые имеют форму сферы и наибольшую вероятность обнаружить электрон вблизи ядра.
На следующем энергетическом уровне могут находиться дополнительные электроны, которые располагаются на p-орбиталях. На этом уровне у атомов бериллия и магния находятся 2 электрона, обозначаемых 2s^2. У атомов кальция, стронция и бария на этом уровне находятся 6 электронов: 2s^2 и 2p^6.
Таким образом, электронная формула энергетического уровня для атомов щелочноземельных металлов имеет вид: 1s^2 2s^2 (2p^6) (3s^2) (3p^6) (4s^2) (3d^10) (4p^6)... Последовательность продолжается в зависимости от энергетических уровней и количества электронов в атоме каждого конкретного металла.
Знание электронной формулы энергетического уровня атомов щелочноземельных металлов является важным для понимания их химических свойств и поведения в химических реакциях. Оно позволяет предсказывать, как атомы щелочноземельных металлов будут взаимодействовать с другими атомами и образовывать различные соединения.
Электронная формула
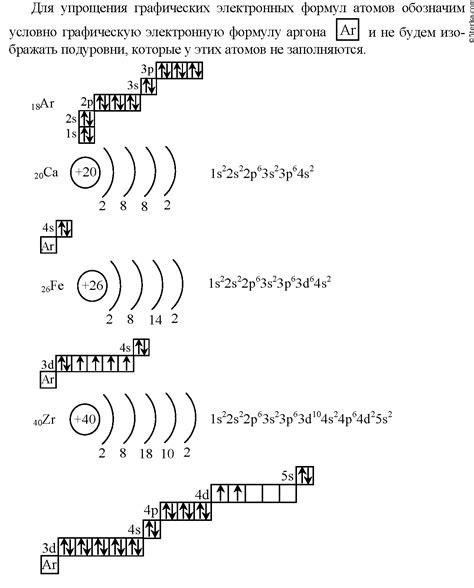
Электронная формула атома щелочноземельного металла позволяет описать распределение электронов по энергетическим уровням и подуровням. Размещение электронов в атоме происходит согласно правилам заполнения энергетических уровней.
Электронную формулу можно записать в виде чисел и букв. Числа указывают на количество электронов в каждом энергетическом уровне, а буквы обозначают подуровни. Например, электронная формула атома кальция находится в виде 2-8-8-2, где первая цифра 2 указывает на наличие 2 электронов в первом энергетическом уровне, вторая цифра 8 - наличие 8 электронов во втором энергетическом уровне, третья цифра также 8 - наличие 8 электронов в третьем энергетическом уровне и последняя цифра 2 - наличие 2 электронов в четвертом энергетическом уровне.
Подуровни обозначаются буквами s, p, d, f, и каждый подуровень может вмещать определенное количество электронов. Например, уровень s может вмещать до 2 электронов, уровень p - до 6 электронов, уровень d - до 10 электронов и уровень f - до 14 электронов. Поэтому атомы щелочноземельных металлов в своей электронной формуле имеют последний энергетический уровень s2.
Энергетический уровень атомов
Энергетический уровень атома является одним из главных понятий в атомной физике. Он характеризует энергетическое состояние атома и определяет возможность перехода электронов из одного состояния в другое. Уровни энергии атома представляют собой дискретные значения энергии, которые могут принимать электроны в атоме.
Атомы щелочноземельных металлов, таких как бериллий, магний, кальций и др., имеют характерную электронную формулу, которая описывает расположение электронов на энергетических уровнях. В электронной формуле указывается количество электронов в каждом энергетическом уровне, начиная с ближайшего к ядру.
Энергетические уровни атомов щелочноземельных металлов образуют серию, которая повторяется похожим образом для каждого элемента. При переходе электронов на более высокие энергетические уровни, атом становится более активным и реакционноспособным. Это объясняется тем, что электроны на высших энергетических уровнях находятся дальше от ядра и слабее связаны с ним.
Уровни энергии атомов щелочноземельных металлов также имеют большое значение для определения цвета и специфических свойств этих элементов. Изменения энергетических уровней электронов при взаимодействии с электромагнитным излучением приводят к поглощению или испусканию света определенной длины волн, что определяет цвет вещества и его фотолюминесцентные свойства.
Щелочноземельные металлы
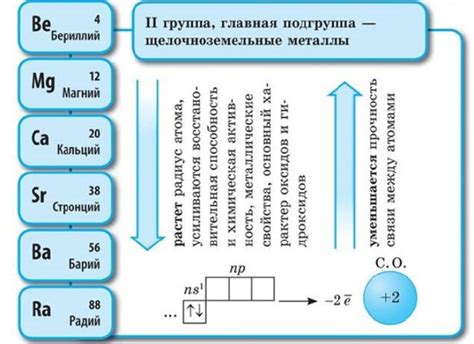
Щелочноземельные металлы – это группа элементов периодической таблицы, которые находятся во второй группе и обладают общими химическими свойствами. К ним относятся бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra).
Щелочноземельные металлы характеризуются высокой активностью и химической реактивностью. Они обладают двумя электронами в внешней электронной оболочке, что делает их склонными к образованию катионов с двойным положительным зарядом.
Электронная формула энергетического уровня атомов щелочноземельных металлов имеет общий вид: 2s2. Это означает, что у каждого атома внешняя электронная оболочка состоит из двух электронов, которые находятся на s-орбитале. Такая электронная конфигурация делает щелочноземельные металлы хорошими проводниками электричества и тепла.
Щелочноземельные металлы широко используются в различных областях науки и промышленности. Например, бериллий используется в производстве сплавов с металлами, магний применяется в производстве авиационных и автомобильных деталей, кальций используется для придания цвета огню, стронций используется в производстве пиротехнических материалов, а барий широко применяется в рентгенологии.
Таким образом, щелочноземельные металлы играют важную роль в современной науке и технологиях. Их уникальные свойства и электронная формула энергетического уровня делают их особо ценными и востребованными в различных отраслях промышленности.
Строение энергетического уровня

Электронная формула энергетического уровня атома щелочноземельного металла описывает распределение электронов по оболочкам и подуровням атома. Энергетический уровень представляет собой набор энергетических состояний, которые могут занимать электроны в атоме.
Строение энергетического уровня щелочноземельных металлов определяется их электронной конфигурацией. Электронная конфигурация щелочноземельных металлов имеет общую форму [нобельев газ] [электронная формула основного состояния]. Например, для кислорода электронная конфигурация будет выглядеть как [гейсий] 2s^2 2p^4.
На энергетическом уровне атома щелочноземельного металла находятся несколько оболочек энергии, каждая из которых состоит из подуровней. Оболочки обозначаются буквами, а подуровни - буквами и цифрами. Например, оболочка "n=1" состоит из подуровня "s", оболочка "n=2" - из подуровней "s" и "p", оболочка "n=3" - из подуровней "s", "p" и "d".
Каждый подуровень имеет ограниченную емкость для размещения электронов. Подуровни "s" могут вместить не более 2 электронов, "p" - не более 6 электронов, "d" - не более 10 электронов. Электроны заполняют подуровни в порядке возрастания их энергии. Электроны наиболее низкоэнергетического уровня называются валентными электронами и определяют химические свойства щелочноземельных металлов.
Электронная конфигурация щелочноземельных металлов

Электронная конфигурация щелочноземельных металлов – это формула, которая описывает распределение электронов в энергетических уровнях атомов данных элементов. Щелочноземельные металлы состоят из двух семейств: магния, кальция, стронция, бария и радия, и обладают общими химическими свойствами, включая высокую реакционность и низкую электроотрицательность.
Электронная конфигурация магния имеет вид 1s^2 2s^2 2p^6 3s^2, что означает наличие 2 электронов в 1s-оболочке, 2 электронов в 2s-оболочке, 6 электронов в 2p-оболочке и 2 электронов в 3s-оболочке. Конфигурация кальция: 1s^2 2s^2 2p^6 3s^2 3p^6 4s^2 – здесь в 4s-оболочке содержится 2 электрона.
Для стронция электронная конфигурация будет иметь следующий вид: 1s^2 2s^2 2p^6 3s^2 3p^6 4s^2 3d^10 4p^6 5s^2. В оболочках от 1s до 4p находятся 18 электронов, в 5s-оболочке – 2 электрона. Конфигурация бария: 1s^2 2s^2 2p^6 3s^2 3p^6 4s^2 3d^10 4p^6 5s^2 4d^10 5p^6 6s^2, где в 6s-оболочке содержится 2 электрона.
Атом радия имеет следующую электронную конфигурацию: 1s^2 2s^2 2p^6 3s^2 3p^6 4s^2 3d^10 4p^6 5s^2 4d^10 5p^6 6s^2 4f^14 5d^10 6p^6 7s^2, где в 7s-оболочке находятся 2 электрона. Наиболее высоким энергетическим уровнем ущелочноземельных металлов является s-оболочка.
Влияние электронной формулы на свойства щелочноземельных металлов

Электронная формула энергетического уровня атома щелочноземельного металла представляет собой схематическое изображение распределения электронов по энергетическим уровням. Именно электронная формула определяет химические и физические свойства этих металлов.
Первый электрон щелочноземельного металла занимает точно такое же энергетическое уровень, как и водородный атом. Второй электрон заполняет следующий энергетический уровень. Такая последовательность заполнения электронных оболочек обуславливает высокую активность щелочноземельных металлов.
Электронные оболочки щелочноземельных металлов имеют свободные s-электроны в своем наиболее внешнем энергетическом уровне. Именно благодаря этим электронам металлы обладают высокой электропроводностью. Отсутствие f- и d-электронов делает электронные структуры щелочноземельных металлов более простыми в сравнении с другими металлами. Это объясняет их способность образовывать соединения с другими элементами.
Обладая только двумя электронами в своем внешнем энергетическом уровне, щелочноземельные металлы имеют тенденцию легко отдавать эти электроны. Именно это свойство позволяет им образовывать прочные и стойкие ионы, что определяет их активность в химических реакциях. Также это свойство позволяет щелочноземельным металлам образовывать соли с кислотами, растворимые в воде.
Вопрос-ответ

Какая электронная формула энергетического уровня атомов щелочноземельных металлов?
Электронная формула энергетического уровня атомов щелочноземельных металлов обычно имеет вид ns^2, где n - номер энергетического уровня.
Какие атомы входят в класс щелочноземельных металлов?
В класс щелочноземельных металлов входят атомы металлов из второй группы периодической системы: бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra).
Что означает нотация ns^2?
Нотация ns^2 означает, что на n-ом энергетическом уровне атома находятся два электрона в подуровне s. Например, для атома кальция (Ca) электронная формула будет 4s^2, что означает наличие четырех электронов на четвертом энергетическом уровне, два из которых находятся в подуровне s.
Как изменяется электронная формула атомов щелочноземельных металлов по мере движения по периодической системе?
Электронная формула атомов щелочноземельных металлов увеличивается по мере движения по периодической системе. Например, для атома бериллия (Be) электронная формула 2s^2, для магния (Mg) - 3s^2, для кальция (Ca) - 4s^2, и так далее.
