Атомы металлов 2а группы периодической системы химических элементов, таких как бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra), имеют интересные электронные структуры, обусловленные особенностями их внешнего энергетического уровня.
В общем случае, электронная формула этих атомов имеет следующий вид: ns2, где n - номер энергетического уровня (2 для атомов металлов 2а группы).
Это значит, что внешний энергетический уровень атомов металлов 2а группы содержит два электрона, расположенных в s-орбитали, что обуславливает их химические свойства. Данные элементы являются химически активными и способны сформировать стабильные соединения с различными элементами.
Атомы металлов 2а группы, в основном, образуют ионные связи, отдавая два электрона соединяющему их неметаллу. Ионный радиус атомов металлов 2а группы увеличивается по мере движения в периоде от бериллия к радию, что обусловлено увеличением числа электронов именно во внешнем энергетическом уровне.
Структура внешнего энергетического уровня

Внешний энергетический уровень атомов металлов 2а группы является последним уровнем электронов в электронной оболочке атома. Он находится на самом большом расстоянии от ядра и содержит самые энергетически активные электроны.
Структура внешнего энергетического уровня характеризуется наличием двух электронов в s-орбиталях. Символ s обозначает форму орбитали, а число 2 – количество электронов с противоположным спином, которые могут находиться в этой орбитали.
По сравнению с атомами металлов 1а группы, у атомов металлов 2а группы на внешнем энергетическом уровне принципиально больше свободных электронов. Это связано с тем, что на нижние энергетические уровни заняты уже все s-орбитали, поэтому электроны вынуждены располагаться на более высоких энергетических уровнях.
Структура внешнего энергетического уровня атомов металлов 2а группы имеет важное значение для их химических свойств. Благодаря наличию двух электронов в s-орбиталях, эти атомы обладают высокой активностью в химических реакциях. Они легко участвуют в обменных реакциях с другими элементами, образуя стабильные соединения.
Физические свойства атомов металлов 2а группы

Атомы металлов 2а группы обладают рядом характерных физических свойств. Одно из них - высокая электропроводность. Атомы металлов 2а группы имеют свободные электроны, которые легко перемещаются внутри металлической решетки. Именно благодаря этому свойству металлы 2а группы являются хорошими проводниками электричества.
Еще одно физическое свойство атомов металлов 2а группы - высокая теплопроводность. Благодаря свободным электронам атомы металлов 2а группы способны быстро передавать тепловую энергию. Это делает эти металлы отличными материалами для производства теплоотводов и теплообменников в различных устройствах и системах.
Кроме того, металлы 2а группы обладают высокой плотностью. Атомы этих металлов тяжелые и компактные, что придает металлам 2а группы большую плотность по сравнению с другими веществами. Именно из-за этого свойства металлы 2а группы обладают твердым и прочным состоянием при обычных условиях.
Кроме указанных свойств, атомы металлов 2а группы также обладают высокой точкой плавления и кипения. Их атомы образуют компактные кристаллические решетки, что обеспечивает высокую стабильность и прочность вещества. Благодаря этим свойствам металлы 2а группы широко применяются в различных отраслях промышленности, включая машиностроение, электронику, авиацию и другие.
Важность электронной формулы в химии
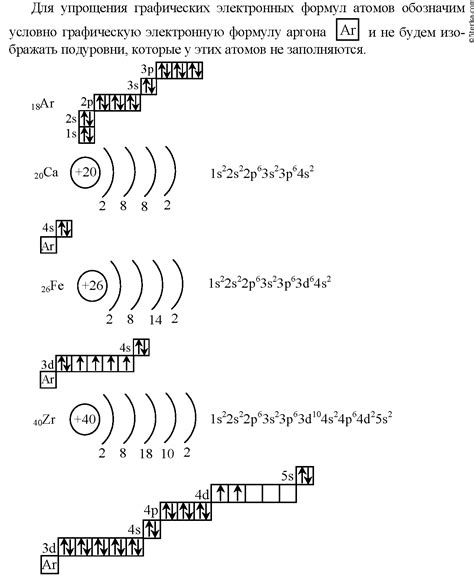
Электронная формула является одним из ключевых инструментов в изучении химии. Она позволяет наглядно представить количество и расположение электронов в атоме и молекуле. Это достаточно простой и удобный способ описать химическую структуру вещества.
Электронная формула является основой для понимания и объяснения химических свойств и реакций веществ. С ее помощью можно предсказать, какие элементы образуют химические связи, какие молекулы имеют положительный или отрицательный заряд, и какие соединения будут стабильными или нестабильными. Без электронной формулы было бы невозможно провести анализ реакций и предсказать их результаты.
Для металлов 2а группы особенно важна электронная формула внешнего энергетического уровня. В ней отображается количество внешних электронов, которые определяют химические свойства металлов. Например, атом магния имеет электронную формулу 2-8-2. Такая формула позволяет понять, что у магния 2 внешних электрона, что делает его активным реакционным веществом.
Электронная формула также является основой для построения моделей молекул и соединений. С ее помощью можно предсказать геометрию молекулы и расположение атомов в пространстве. Это важно при изучении свойств и реакций химических соединений, а также при проектировании новых веществ и материалов.
Таким образом, электронная формула играет ключевую роль в химии, позволяя нам лучше понять химическую структуру, свойства и поведение веществ. Она является основой для глубокого анализа химических реакций и предсказания их результатов, а также полезным инструментом для создания новых соединений и материалов.
Вопрос-ответ

Какова структура внешнего энергетического уровня атомов металлов 2а группы?
С вариабельным количеством валентных электронов, внешний энергетический уровень атомов металлов 2а группы имеет структуру s-подуровня.
Каково значение валентных электронов для атомов металлов 2а группы?
Значение валентных электронов для атомов металлов 2а группы составляет 2.
Какие элементы относятся к металлам 2а группы?
К металлам 2а группы относятся бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra).
Какое количество электронов имеет внешний энергетический уровень у атомов металлов 2а группы?
Внешний энергетический уровень у атомов металлов 2а группы имеет вариабельное количество электронов в зависимости от конкретного элемента (от 1 до 2 электронов).
Какая электронная формула характерна для атомов металлов 2а группы?
Для атомов металлов 2а группы характерна электронная формула ns^2, где n - главное квантовое число, s - орбиталь с шарообразной формой.
