В химии электронная формула – это способ представления строения атомов и молекул с использованием символов химических элементов и их валентностей. Она позволяет описать расположение электронов в атоме и молекуле, а также предсказать и объяснить свойства и реакции веществ. В данной статье мы рассмотрим электронную формулу и ее значение для типичных металлов.
Металлы – это группа химических элементов, обладающих своеобразными свойствами, такими как блеск, теплопроводность, электропроводность и пластичность. Эти свойства связаны с особенностями их электронной структуры. Металлы обычно имеют малое количество валентных электронов, что делает их подходящими для образования металлических связей и образования кристаллической решетки.
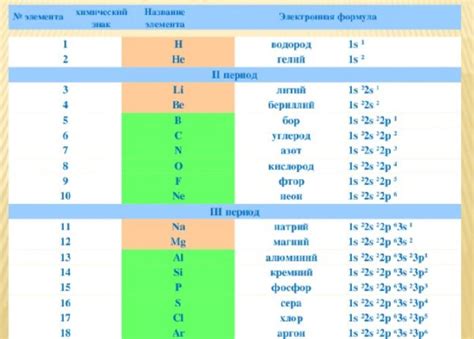
Для типичных металлов электронная формула может быть представлена в виде общей схемы, которая показывает распределение электронов на энергетических уровнях. Например, для железа, в электронной формуле указывается, что у атома железа на внешней оболочке находится два электрона, а на следующем энергетическом уровне – восемь электронов. Это говорит о том, что железо является типичным металлом с двумя валентными электронами.
Используя электронную формулу, можно легко определить некоторые общие свойства и характерные реакции типичных металлов. Например, металлы обладают способностью легко отдавать или принимать электроны, что позволяет им образовывать ионы с положительным зарядом. Это объясняет их способность к образованию соединений с неметаллами и созданию металлических решеток с характерным металлическим связыванием.
В заключение, электронная формула является важным инструментом для понимания строения и свойств химических элементов, включая типичные металлы. Она позволяет предсказывать и объяснять разнообразные реакции и взаимодействия веществ, а также делает возможным разработку новых материалов и технологий на основе металлов.
Электронная формула и ее роль в определении свойств металлов
Электронная формула является основным инструментом для описания свойств металлов и определения их химической активности. Она позволяет изучить распределение электронов в атоме металла и его валентную структуру.
В электронной формуле металла указывается общее число электронов в атоме и их распределение по энергетическим уровням. Эта информация позволяет понять, каким образом металл вступает в химические реакции и какие свойства он проявляет.
Электронная формула металла также помогает объяснить его химическую активность. Например, особенности распределения электронов могут влиять на способность металла образовывать соединения с различными элементами. Электронная формула также позволяет определить валентность металла - его способность образовывать ионные соединения и взаимодействовать с другими веществами.
Из электронной формулы также можно сделать выводы о магнитных и электрических свойствах металла. Например, наличие неспаренных электронов во внешних оболочках может указывать на возможность образования магнитного поля при наличии внешнего магнитного поля. Также электронная формула позволяет определить проводимость металла, исходя из наличия свободных электронов в его структуре.
В целом, электронная формула является мощным инструментом для исследования и определения свойств металлов. Она помогает понять, каким образом атомы металла взаимодействуют с другими элементами и обуславливают их физические и химические свойства.
Роль электронной формулы в определении типичных металлов

Электронная формула играет важную роль в определении типичных металлов. Она позволяет анализировать и понимать особенности строения и взаимодействия атомов в металлической структуре.
В электронной формуле внешние электроны, или электроны валентной оболочки, отображаются в виде символов, обозначающих электроны. Эти электроны играют важную роль в химическом поведении атомов и определяют их типичные свойства.
Металлы, как правило, имеют небольшое количество валентных электронов, что делает их склонными к образованию ионов с положительным зарядом. Это связано с их строением - после образования кристаллической решетки, в которой каждый атом окружен ближайшими соседями, оставшиеся свободными электроны образуют так называемую "электронную оболочку".
Имея такую электронную оболочку, типичные металлы обладают свойствами высокой электропроводности, теплопроводности и пластичности. Это объясняется способностью электронов перемещаться свободно внутри кристаллической решетки и передавать энергию и электрический ток. Кроме того, металлы обычно формируют положительно заряженные ионы, которые образуют кристаллическую решетку с отрицательно заряженными электронами.
Таким образом, электронная формула является важным инструментом для определения типичных металлов и понимания их уникальных химических и физических свойств. Она позволяет установить связь между строением металлической решетки и проявлением основных характеристик металлов.
Свойства и особенности металлов с определенной электронной формулой
Металлы - один из основных классов веществ, обладающих специфическими физическими и химическими свойствами. Ключевыми свойствами металлов являются высокая электропроводность, теплопроводность и высокая пластичность. Большинство металлов находятся в левой части периодической системы, где расположены элементы с так называемой "электронной формулой с оболочкой s2p1 или s2p0".
Металлы с электронной формулой с оболочкой s2p1 включают группы 1 и 2 периодической системы. Эти металлы, такие как литий, натрий, калий и магний, обладают высокой активностью и элементарной формой образуют катионы с положительным зарядом. Они легко реагируют с водой, освобождая водород, и представляют собой основу общеизвестных щелочных и щелочноземельных металлов.
Металлы с электронной формулой с оболочкой s2p0 представлены в группах 13-18 периодической системы. Эти металлы, такие как алюминий, кремний, фосфор и сера, обладают высокой прочностью, но имеют незначительную электропроводность и теплопроводность по сравнению с металлами из групп 1 и 2. Они являются ключевыми элементами в производстве полупроводников, поскольку способны изменять проводимость под воздействием различных факторов.
Металлы с определенной электронной формулой обладают также рядом других особенностей. Например, они хорошо отражают свет и могут быть использованы в производстве зеркал и других оптических устройств. Кроме того, металлы обладают способностью образовывать сплавы и специфические металлические соединения, что делает их незаменимыми в промышленности и технологиях.
В целом, металлы с определенной электронной формулой представляют собой важную группу веществ, которые играют непревзойденную роль в нашей повседневной жизни, от использования в электронике и технологиях до строительства и производства различных изделий.
Электронная формула и металлическая связь

Электронная формула – это способ представления электронного строения атомов в молекуле или кристаллической решетке. В случае металлов, электронная формула позволяет понять основные особенности их строения и свойств.
Основным характеристическим признаком металлов является наличие "моря" свободных электронов, образующих электронный газ. В электронной формуле металла эти свободные электроны обозначаются как "э." Обычно они находятся в валентной зоне, то есть зоне энергии, которая близка к зоне проводимости. Именно эти свободные электроны и обеспечивают металлу такие свойства, как электропроводность, теплопроводность и гибкость.
Металлическая связь определяется взаимодействием между свободными электронами и положительно заряженными ионами металла. В результате этого взаимодействия образуется металлическая сеть, которая может быть представлена в виде кристаллической решетки. Металлические связи очень прочные и обладают металлом характеристиками, такими как тугоплавкость, благодаря высокой температуре плавления, и устойчивость к механическим воздействиям.
Электронная формула и металлическая связь позволяют объяснить не только физические свойства металлов, но и их химическую реактивность. Свободные электроны делают металлы активными в отношении многих веществ, что приводит к образованию разнообразных соединений и сплавов. Кроме того, электронная формула помогает определить, какой тип металла мы имеем дело – щелочной, щелочноземельный, переходный или блок p-элементов.
Примеры металлов с различными электронными формулами
Металлы – это элементы, обладающие способностью проводить электрический ток и имеющие глянцевый металлический блеск. На основе их электронной структуры можно выделить несколько типов металлов с различными электронными формулами.
Например, щелочные металлы, такие как литий (Li), натрий (Na) и калий (K), имеют одну электронную формулу внешней оболочки: s1. Это значит, что в их внешней оболочке находится всего один электрон.
Алкальноземельные металлы, такие как магний (Mg), кальций (Ca) и барий (Ba), имеют электронную формулу внешней оболочки: s2. В их внешней оболочке находятся два электрона.
Переходные металлы, например железо (Fe), медь (Cu) и цинк (Zn), имеют сложные электронные формулы внешней оболочки. Они обладают несколькими энергетическими уровнями и различным числом электронов в оболочке.
Другой пример – благородные металлы, такие как золото (Au), платина (Pt) и серебро (Ag). У них электронная формула внешней оболочки включает s- и d-орбитали.
Также стоит упомянуть о лантаноидных и актиноидных металлах. Эти элементы из группы лантаноидов и антилантаноидов имеют сложные электронные формулы внешних оболочек и способность образовывать соединения с различными валентностями.
В целом, химические свойства металлов определяются их электронной структурой, а различные электронные формулы обуславливают разнообразие их свойств и химических реакций.
Зависимость электронной формулы металла от его положения в периодической системе

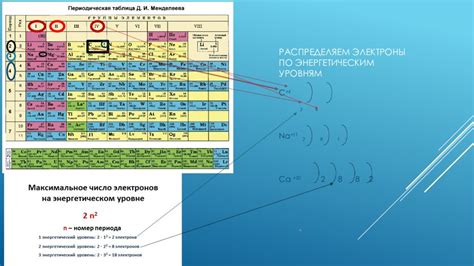
Электронная формула металла определяет распределение электронов в его внешней электронной оболочке, что в свою очередь влияет на его химические и физические свойства. Зависимость этой формулы от положения металла в периодической системе строится на основе его электронной конфигурации, которая определяет число электронов в каждом энергетическом уровне.
Металлы в периодической системе располагаются слева от линии, отделяющей металлы от неметаллов. В основном, металлы имеют от одного до трех электронов в своей внешней электронной оболочке. Это так называемые электроны валентной оболочки, которые играют ключевую роль в химических реакциях металлов.
Например, у щелочных металлов, таких как литий, натрий и калий, на внешнем энергетическом уровне находится один электрон. Их электронная формула будет иметь вид ns1, где "n" - номер энергетического уровня. Эти металлы легко отдают свой валентный электрон, образуя катион с положительным зарядом.
Другие металлы, такие как алюминий и железо, имеют внешнюю электронную оболочку с двумя электронами. Их электронная формула будет иметь вид ns2. Такие металлы могут как отдавать свои электроны, образуя катионы, так и принимать электроны, образуя анионы с отрицательным зарядом.
Таким образом, электронная формула металла является важным аспектом его химической активности и реакционной способности. Она определяет поведение металла при взаимодействии с другими веществами и молекулами и играет роль в формировании свойств металлических материалов, используемых в различных отраслях промышленности и технологий.
Практическое применение знания об электронной формуле для типичных металлов

Знание об электронной формуле типичных металлов имеет практическое применение в различных областях, таких как химическая промышленность, электроника, металлургия и другие.
В химической промышленности электронная формула металлов помогает определить их свойства и способы взаимодействия с другими веществами. Например, зная электронную формулу меди (Cu), можно предсказать ее способность вступать в реакции окисления и взаимодействия с кислородом. Это информация важна при проектировании и производстве материалов, которые должны быть устойчивыми к окислению или коррозии.
В электронике электронная формула металлов необходима для понимания их электрических свойств. Например, знание электронной формулы алюминия (Al) позволяет предсказать его хорошую проводимость электричества. Это делает алюминий одним из основных материалов для проводов и контактных площадок в различных электронных устройствах.
В металлургии знание электронной формулы металлов важно для контроля качества и процессов обработки металлических сплавов. Например, электронная формула железа (Fe) позволяет понять его способность вступать в химические реакции и образовывать сплавы с другими металлами. Это знание позволяет контролировать состав и свойства сплавов, что важно для производства прочных и долговечных металлических конструкций.
Таким образом, знание об электронной формуле типичных металлов имеет практическую ценность в различных отраслях промышленности, позволяя предсказывать и контролировать их свойства и поведение в химических реакциях. Это помогает разработке новых материалов, улучшению производственных процессов и созданию более эффективных и надежных изделий.
Вопрос-ответ

Можете объяснить, что такое электронная формула?
Электронная формула - это обозначение атомов и связей между ними в молекуле или соединении. Она показывает распределение электронов по орбиталям атомов и помогает предсказать химические свойства вещества.
Какие типичные металлы можно найти в периодической таблице?
В периодической таблице можно найти множество металлов, однако типичными металлами являются железо (Fe), алюминий (Al), медь (Cu), свинец (Pb), цинк (Zn) и никель (Ni). Они обладают хорошей электропроводностью, теплопроводностью и обычно имеют блестящую поверхность.
Как можно определить типичный металл по его электронной формуле?
Определить типичный металл по его электронной формуле можно, глядя на количество валентных электронов у атома. Типичные металлы имеют небольшое количество валентных электронов и склонны отдавать их, чтобы образовать положительные ионы. Также, типичные металлы расположены слева от периодической таблицы.
