Кальций – один из наиболее распространенных металлов в земной коре. Он является одним из основных компонентов молодежного мантия и составляет примерно 3% массы Земли. Кальций имеет атомный номер 20 и химический символ Ca в периодической таблице элементов.
В электронной формуле металла кальция отображается его электронная конфигурация. Кальций имеет общую электронную конфигурацию [Ar] 4s2, что означает, что у него есть 20 электронов.
Внешний электронный уровень кальция – 4s, на котором находятся 2 электрона. Остальные 18 электронов распределены на более низких энергетических уровнях. Это делает металл кальция реактивным, поскольку его внешние электроны могут участвовать в химических реакциях.
Строение кристаллической решетки кальция также играет важную роль в его свойствах. Кальций кристаллизуется в кубической гранецентрированной решетке, в которой каждый атом кальция окружен восемью соседними атомами. Это создает прочную и стабильную структуру, что делает кальций твердым и пластичным металлом, который можно легко обработать и использовать в различных промышленных отраслях.
Состав металла кальция

Кальций - химический элемент периодической системы, который относится к щелочноземельным металлам. Его атомный номер равен 20, а атомная масса примерно равна 40,08 г/моль. Кальций представляет собой серебристо-белый металл, который обладает отличной проводимостью электричества и тепла.
Атомный радиус кальция составляет около 197 пикометров, а его электронная конфигурация представляется следующим образом: 1s^2 2s^2 2p^6 3s^2 3p^6 4s^2. Это означает, что в атоме кальция располагается 20 электронов, из которых два находятся на первом энергетическом уровне, восьмь на втором и десять на третьем.
Сам металл кальция не существует в природе в свободном виде, так как он очень реактивен. Его можно найти только в составе соединений, например, в виде оксида кальция (известного как известь) или хлорида кальция. Коммерческий металл кальция производят электролизом расплавленной соли кальция или путем редукции оксидов кальция с помощью алюминия.
Кальций имеет широкий спектр применений в различных отраслях промышленности. Он используется в производстве стали и алюминиевых сплавов, а также является необходимым компонентом бетона и строительных материалов. Кальций также используется в производстве стекла, керамики и пластика, а также в агрохимии для улучшения почвы. Благодаря своей активной реактивности, кальций широко применяется в химической промышленности для получения различных соединений и процессов.
Атомы

Атомы - это основные строительные блоки вещества. Они состоят из ядра, которое содержит протоны и нейтроны, и облака электронов, которое окружает ядро. Атомы различаются по количеству протонов, которые определяют их химические свойства и порядковый номер элемента в периодической таблице.
Кальций - химический элемент с атомным номером 20. Кальций имеет двадцать электронов, распределенных по облаку внешних электронов. В электронной формуле кальция электроны расположены на энергетических уровнях: 2 на первом уровне, 8 на втором уровне и 8 на третьем уровне.
Структура атома кальция можно представить схематически с помощью таблицы:
| Энергетический уровень | Количество электронов |
|---|---|
| 1 | 2 |
| 2 | 8 |
| 3 | 8 |
Такая структура атома кальция обеспечивает его химические свойства и возможности для взаимодействия с другими веществами. Электроны на внешнем уровне являются валентными электронами, которые отвечают за химическое соединение элемента с другими веществами.
Элементы

В химии понятие элементов относится к веществам, которые не могут быть разделены на более простые вещества химическими методами. В таблице периодических элементов представлены все известные элементы, обозначенные символами и расположенные в порядке возрастания атомного номера.
Каждый элемент характеризуется своими уникальными физическими и химическими свойствами. Один из основных способов классификации элементов - это их электронная конфигурация, которая указывает на распределение электронов по энергетическим уровням и подуровням.
Электронная формула элемента представляет собой запись, показывающую количество электронов в каждом энергетическом уровне и подуровне. Например, для элемента кальция (Ca) электронная формула будет выглядеть следующим образом: 1s^2 2s^2 2p^6 3s^2 3p^6 4s^2.
По электронной формуле можно определить множество свойств элемента, таких как его химическую реактивность, способность образовывать соединения и участие в химических реакциях. Кальций, например, является активным металлом, который реагирует с водой, кислородом и другими веществами.
Строение металла кальция

Металл кальция имеет кубическую решетку гранецентрированной структуры, которая отличается высокой плотностью упаковки атомов. Внутри решетки каждый углеродный атом окружен восемью соседними атомами, а к каждой решеточной плоскости вокруг атома прилегают двенадцать самых ближайших соседей.
Структура металла кальция обеспечивает ему такие характеристики, как высокая термическая и электрическая проводимость, а также пластичность. Эти свойства обусловлены особенностями решетки, в которой атомы металла свободно перемещаются, образуя так называемую "электронную облако". В результате металл кальция обладает высокой теплопроводностью и способностью к деформации без разрушения структуры.
Образование узкой электронной зоны в металле кальция позволяет ему проявлять металлическое свойство ковкости и пластичности. А наличие свободных электронов на решетке обуславливает хорошие электрические и тепловые свойства металла.
Кристаллическая решетка
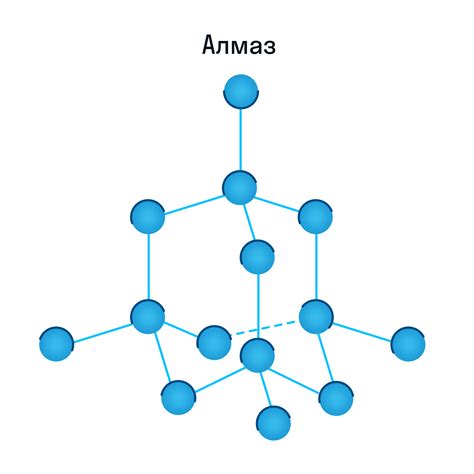
Кристаллическая решетка является основной структурной единицей металла кальция. Она представляет собой трехмерную упорядоченную систему, состоящую из атомов кальция, которые занимают определенные позиции в пространстве.
Кристаллическая решетка металла кальция является кубической гранецентрированной (с гранями и центральным размещением атомов). Это означает, что каждый атом кальция окружен восемью ближайшими соседями, которые расположены на углах куба и в его центре.
Такая структура решетки обеспечивает металлу кальция высокую прочность, жесткость и устойчивость к деформации. Атомы кальция тесно связаны друг с другом через ковалентные и металлические связи, что позволяет образовывать крепкую структуру и обеспечивать металлу его основные физические и химические свойства.
Кристаллическая решетка металла кальция также обладает регулярностью и симметрией, что способствует его хорошей проводимости электричества и тепла. Каждый атом кальция имеет валентность +2 и является электроположительной частицей. В результате, металл кальция образует сильные и устойчивые связи между атомами, что делает его хорошим проводником электричества и тепла.
Атомная структура
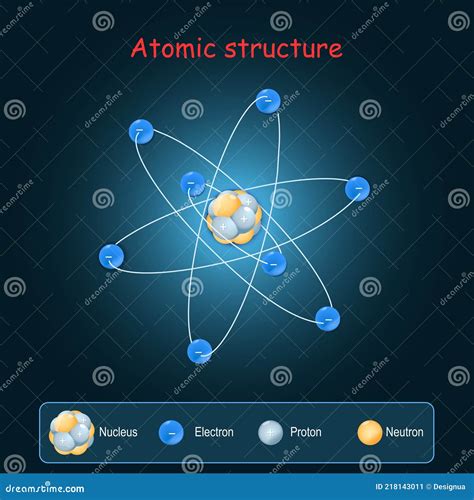
Металл кальция (Ca) имеет атомную структуру, которая определяется его электронной формулой. Атом кальция состоит из ядра, в котором находятся 20 протонов и 20 нейтронов. Вокруг ядра обращаются электроны, распределенные по энергетическим уровням.
Атомный радиус кальция составляет около 197 пикометров (1 пикометр = 10^-12 метра). Он отражает размер атома кальция, который может быть представлен в виде сферической оболочки. Кальций имеет 4 энергетических уровня для электронов: первый уровень содержит 2 электрона, второй - 8 электронов, третий - 8 электронов, а четвертый - 2 электрона.
Внешняя электронная оболочка кальция, называемая валентной оболочкой, содержит 2 электрона. Она играет важную роль в химических реакциях, так как эти электроны могут участвовать в обмене или передаче электронов с другими атомами. Кальций, будучи щелочно-земельным металлом, образует двухвалентные ионы, отдавая 2 электрона из своей валентной оболочки.
В целом, атомная структура кальция является основой его химических свойств и позволяет объяснить его взаимодействие с другими веществами и соединениями. Изучение этой структуры является важным для понимания многих процессов, связанных с кальцием и его применением в различных областях науки и технологий.
Электронная формула металла кальция

Металл кальций имеет атомную формулу Ca и принадлежит к группе щелочноземельных металлов. Его электронная конфигурация состоит из 20 электронов, распределенных по энергетическим уровням и подуровням.
Первый энергетический уровень содержит 2 электрона, второй - 8 электронов, третий - 8 электронов, а четвертый - 2 электрона. Это означает, что во внешней оболочке кальция находятся 2 электрона, что делает его активным металлом.
Электронная формула кальция можно записать в виде 2,8,8,2, где каждая цифра соответствует числу электронов на соответствующих энергетических уровнях. Для удобства записи электронной формулы иногда используется сокращенный вариант - [Ar] 4s2.
Атом металла кальция в электронной формуле имеет два электрона на внешнем энергетическом уровне, что делает его склонным к отдаче этих электронов и образованию положительного иона Ca2+.
Электронная формула металла кальция позволяет понять его строение и свойства. Наличие двух электронов на внешнем энергетическом уровне делает кальций реактивным металлом, способным образовывать ионы, участвовать в химических реакциях и образовывать соединения с другими элементами.
Вопрос-ответ

Каков состав и строение металла кальция в электронной формуле?
Символьная формула кальция в электронной конфигурации: Ca: [Ar] 4s2. Это означает, что у кальция внешний электронный слой содержит 2 электрона, а остальные электроны находятся во внутренних слоях.
Какие оболочки электронов есть у металла кальция?
У металла кальция есть две электронные оболочки: внутренняя оболочка, которая состоит из электронов с номерами 1 и 2, и внешняя оболочка, которая состоит из 2 электронов.
Какие подуровни электронов есть у металла кальция?
У металла кальция есть два подуровня электронов: 4s1 и 4s2. Внутренние слои, содержащие 2 электрона, обозначаются буквой "s", а число после "s" указывает количество электронов в данном подуровне.
Какова электронная формула металла кальция?
Электронная формула кальция выглядит следующим образом: [Ar] 4s2. Это означает, что первые 18 электронов металла кальция находятся во внутренних оболочках с электронной конфигурацией аргония, а оставшиеся 2 электрона расположены на внешней оболочке в подуровне 4s2.
