В химии щелочные металлы являются основными элементами периодической таблицы, находящимися в первой группе. Среди них наиболее распространены литий (Li), натрий (Na), калий (K), рубидий (Rb) и цезий (Cs). Структура электронного оболочечного заряда щелочных металлов определяет их химические свойства и реактивность. Это связано с особенностями расположения электронов на энергетических уровнях и спин-орбитального взаимодействия.
У щелочных металлов в атоме всего одна электронная оболочка, которая содержит одну или две валентные электроны. Эти электроны находятся на самом наружном энергетическом уровне, который называется s-орбиталью. Такое расположение электронов делает щелочные металлы очень реактивными, так как они стремятся потерять эти валентные электроны и образовать положительный ион.
Структура электронного оболочечного заряда щелочных металлов также определяет их характеристики металлического связывания. Эти элементы обладают низкой электроотрицательностью и высокой электропроводностью благодаря гибкой структуре электронов на самом внешнем энергетическом уровне. Они легко образуют металлические решетки и могут образовывать ионы в металле, что позволяет им проявить свои металлические свойства.
Понятие электронной оболочки

Электронная оболочка – это область пространства вокруг атомного ядра, в которой находятся электроны. Она состоит из нескольких энергетических уровней, на которых размещаются электроны в соответствии с принципом заполнения.
Электронная оболочка имеет определенную структуру. На самом низшем энергетическом уровне располагается первая оболочка, которая вмещает не более 2 электронов. На втором энергетическом уровне располагается вторая оболочка, на которой может находиться до 8 электронов.
Далее энергетические уровни имеют большую емкость и могут вмещать до 18, 32, 50 и т. д. электронов. Когда энергетические уровни заполняются полностью, электроны начинают размещаться на следующем уровне.
Структура электронной оболочки щелочных металлов определяет их химические свойства. На первом энергетическом уровне находится 2 электрона, а на втором – 8 электронов. Это делает щелочные металлы очень реакционноспособными, так как они стремятся избавиться от лишних электронов и достигнуть электронной конфигурации инертного газа.
Основные составляющие структуры
Структура электронного оболочечного заряда щелочных металлов имеет несколько основных составляющих.
Во-первых, это внутренняя оболочка, которая состоит из заряженных ядерных частиц - протонов и нейтронов. Ядра расположены в центре атома и создают положительный заряд, который притягивает электроны.
Во-вторых, это электронные оболочки, которые окружают ядро. Электроны находятся на разных энергетических уровнях - внутренних и внешних. Внутренние оболочки могут содержать до 2 электронов, а внешняя оболочка - до 8 электронов.
Каждая электронная оболочка имеет свой энергетический уровень, который определяет его положение в атоме. Они располагаются по принципу энергетической лестницы, где нижние уровни имеют меньшую энергию, а верхние - большую.
Также щелочные металлы имеют наружную электронную оболочку, на которой находятся свободные электроны. Они легко отдают эти электроны и образуют положительные ионы. Это обусловлено тем, что наружная оболочка содержит только один или два электрона, что делает их нестабильными и готовыми к отдаче.
Расположение электронов на оболочках

Структура электронного оболочечного заряда щелочных металлов определяется расположением электронов на их оболочках. Оболочки щелочных металлов состоят из нескольких подуровней, каждый из которых может быть заполнен электронами.
На первой оболочке щелочных металлов находится только один подуровень, обозначаемый буквой "s". Этот подуровень может вместить максимум 2 электрона. Это объясняет химические свойства щелочных металлов, такие как отдача электрона при взаимодействии с другими элементами.
На второй оболочке находятся два подуровня - "s" и "p". Подуровень "s" может вместить до 2 электронов, а подуровень "p" - до 6 электронов. Это означает, что вторая оболочка щелочных металлов может содержать максимум 8 электронов.
На третьей оболочке также находятся два подуровня - "s" и "p". Подуровень "s" вмещает до 2 электронов, а подуровень "p" - до 6 электронов. Третья оболочка щелочных металлов может содержать максимум 8 электронов.
Таким образом, структура электронного оболочечного заряда щелочных металлов определяется количеством электронов на каждом из подуровней на оболочках. Это важное свойство щелочных металлов, которое определяет их реактивность и способность образовывать ионы.
Влияние атомного радиуса на оболочечный заряд

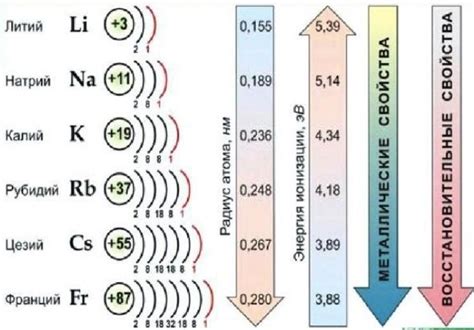
Атомный радиус щелочных металлов является важным фактором, определяющим структуру и свойства их электронной оболочки. Щелочные металлы, такие как литий, натрий, калий и др., имеют большой атомный радиус, что создает определенные особенности их электронной структуры.
Большой атомный радиус позволяет щелочным металлам иметь малое количество электронов в внешней оболочке. Это связано с тем, что большой атомный радиус создает слабое притяжение между электронами и ядром, что позволяет электронам легко перемещаться и участвовать в химических реакциях.
Также влияние атомного радиуса на оболочечный заряд проявляется в энергии ионизации щелочных металлов. Как правило, чем меньше атомный радиус, тем больше энергия ионизации. Это объясняется тем, что при уменьшении атомного радиуса увеличивается притяжение между ядром и электронами, что затрудняет отрыв электрона от атома.
Нажми здесь чтобы перейти к таблице с данными по щелочным металлам
Щелочные металлы и их электронная оболочка

Щелочные металлы составляют первую группу элементов периодической системы. Они включают в себя литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они отличаются высокой активностью и реактивностью, что связано с их электронной оболочкой.
Каждый щелочный металл имеет одну валентную электрон в своей внешней оболочке. Валентный электрон это электрон, находящийся на самом высоком энергетическом уровне и ответственный за химические свойства элемента. Ущельянные металлы характеризуются тем, что их электронную оболочку можно описать формулой ns1, где n - номер энергетического уровня.
Электронная оболочка щелочных металлов имеет весьма слабое взаимодействие между электронами и ядром атома. Это позволяет легко отделять валентный электрон и приводит к высокой реактивности данных элементов. Например, щелочные металлы реагируют с водой, выделяя водородный газ и образуя щелочи. Также они образуют соли с различными кислотами и проявляют металлическую прокатку.
В целом, электронная оболочка щелочных металлов играет важную роль в их химических свойствах и реактивности. Понимание этой структуры позволяет углубить знания о данной группе элементов и их характеристиках.
Структура оболочек щелочных металлов
Щелочные металлы, такие как литий, натрий, калий и другие, имеют особенную структуру своих оболочек. В основе этой структуры лежат электронные оболочки, которые окружают ядро атома. Каждая электронная оболочка состоит из нескольких подоболочек, на каждой из которых располагаются электроны. Структура этих оболочек и количество электронов на каждой из них определяют свойства и химическую активность щелочных металлов.
Наиболее внутренняя оболочка, называемая K-оболочкой, содержит два электрона. Она находится ближе всего к ядру атома и имеет наибольшую энергию. Следующая оболочка, L-оболочка, уже может содержать до 8 электронов. L-оболочка вторая по удаленности от ядра и имеет меньшую энергию, чем K-оболочка. Наиболее внешняя оболочка, M-оболочка, может содержать до 18 электронов и имеет меньшую энергию, чем оболочки K и L.
Структура этих оболочек объясняет химическую активность щелочных металлов. Поскольку у щелочных металлов отсутствуют d- и f-оболочки, наличие одного электрона в внешней оболочке делает их очень реакционноспособными. Они стремятся отдать этот электрон и образовать ион с положительным зарядом. Таким образом, структура оболочек щелочных металлов является ключевым фактором, определяющим их химические свойства и реактивность.
Вопрос-ответ

Какая структура электронного оболочечного заряда щелочных металлов?
Электронный оболочечный заряд щелочных металлов имеет структуру с одним электроном в внешней оболочке.
Что такое электронный оболочечный заряд щелочных металлов?
Электронный оболочечный заряд щелочных металлов - это сумма зарядов электронов во всех оболочках атома щелочного металла.
Какова особенность структуры электронного оболочечного заряда щелочных металлов?
Особенностью структуры электронного оболочечного заряда щелочных металлов является наличие одного электрона в внешней оболочке, что делает их очень реакционноспособными.
Почему электронный оболочечный заряд щелочных металлов имеет такую структуру?
Электронный оболочечный заряд щелочных металлов имеет такую структуру из-за особенностей их электронной конфигурации, где на последней, внешней оболочке находится всего один электрон.
