Электронная формула щелочного металла: 1s2 2s2 2p6 3s3 представляет собой запись, которая показывает, какие электроны находятся на каждом энергетическом уровне атома этого металла. Это нотация, основанная на орбитальной модели атома, где энергетические уровни представляют собой энергетические "оболочки", а электроны заполняют эти оболочки в определенном порядке.
Электронная формула щелочного металла основана на принципе электронной конфигурации, который заключается в том, что электроны заполняют оболочки в порядке возрастания их энергии. Таким образом, каждая цифра в формуле отражает количество электронов на соответствующем энергетическом уровне.
Первая цифра в формуле, 1s2, указывает на наличие двух электронов на первом энергетическом уровне, обозначаемом как 1s. Затем следуют 2s2, что означает наличие четырех электронов на втором энергетическом уровне, обозначаемом как 2s. Далее идет 2p6, указывающее на наличие шести электронов на втором энергетическом уровне, обозначаемом как 2p. И, наконец, 3s3 обозначает наличие трех электронов на третьем энергетическом уровне, обозначаемом как 3s.
Электронная формула щелочного металла позволяет легко определить, сколько электронов находится на каждом энергетическом уровне атома данного металла. Это основополагающая информация, которая позволяет понять электронную структуру атома и его химические свойства.
Структура электронной формулы щелочного металла

Щелочные металлы являются одной из основных групп химических элементов, отличающихся своими химическими свойствами и электронной структурой. Они включают в себя элементы, такие как литий (Li), натрий (Na), калий (K) и другие. Электронная формула щелочного металла описывает расположение электронов в атоме и позволяет понять особенности его химических реакций и свойств.
Структура электронной формулы щелочного металла представлена в виде последовательности энергетических уровней и подуровней, на которых находятся электроны. Например, электронная формула щелочного металла 1s2 2s2 2p6 3s3 для одного из этих элементов означает следующее:
- Первый энергетический уровень (n=1) содержит 2 электрона, заполняющих s-подуровень (s).
- Второй энергетический уровень (n=2) содержит 2 электрона, занимающих s-подуровень (s), и 6 электронов, расположенных на p-подуровне (p).
- Третий энергетический уровень (n=3) содержит 3 электрона, занимающих s-подуровень (s).
Электроны в щелочных металлах имеют склонность к потере одного электрона, формируя положительно заряженные ионы. Это связано с тем, что электронная структура щелочных металлов близка к стабильной электронной конфигурации эдельгазов. При потере одного электрона, электронная формула щелочного металла становится более устойчивой и соответствует электронной формуле соответствующего эдельгаза.
Структура электронной формулы щелочного металла является одной из основных особенностей данных элементов и определяет их химические свойства и реактивность. Понимание электронной структуры щелочных металлов играет важную роль в различных областях, от химии до материаловедения, и помогает в изучении их физических и химических свойств.
Рассмотрение 1s2 2s2 2p6 3s3

Электронная формула щелочного металла: 1s2 2s2 2p6 3s3, где каждое число обозначает количество электронов в соответствующей оболочке. Рассмотрим эту формулу подробнее.
Первые два электрона (1s2) находятся в 1s-оболочке. Эта оболочка является самой близкой к ядру атома и может вместить только два электрона. Оба электрона могут считаться заполненными и находиться в основном энергетическом уровне.
Следующие четыре электрона (2s2 2p6) находятся в 2s- и 2p-оболочках. Оболочка 2s может вместить до двух электронов, поэтому она заполнена полностью. Оболочка 2p может вместить до шести электронов и содержит шесть используемых электронов.
Последние три электрона (3s3) находятся в 3s-оболочке. Эта оболочка является основной внешней оболочкой и на данный момент содержит три электрона. 3s-оболочка может вместить до восьми электронов, поэтому она еще не заполнена полностью.
Итак, электронная формула щелочного металла 1s2 2s2 2p6 3s3 указывает на наличие двух электронов в 1s-оболочке, четырех электронов в 2s-оболочке, шести электронов в 2p-оболочке и трех электронов в 3s-оболочке. Всего в атоме щелочного металла на данный момент находится 15 электронов.
Электронная конфигурация щелочного металла
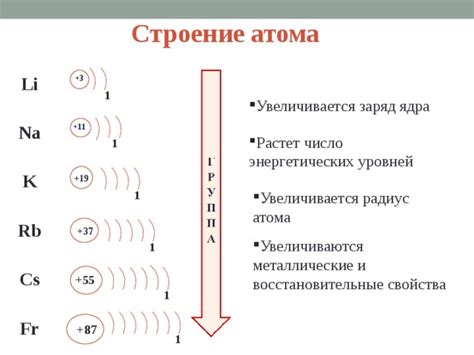
Щелочные металлы – это группа элементов периодической таблицы, которые находятся в первой группе (IA). Такие металлы включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они отличаются от других металлов своей низкой плотностью, низкой температурой плавления и высокой реактивностью.
У всех щелочных металлов общая химическая особенность – одно электронное внешнее энергетическое уровня s. Это значит, что эти металлы имеют один электрон в s-орбитали своей последней энергетической оболочки.
Электронная формула щелочного металла 1s2 2s2 2p6 3s3 означает следующее: внутренняя энергетическая оболочка содержит 2 электрона (1s2), следующая оболочка – 8 электронов (2s2 2p6), а на внешнем уровне находятся 3 электрона (3s3).
Из-за того, что внешняя электронная оболочка недостаточно стабильна, щелочные металлы стремятся отдать свой внешний электрон. Это делает их очень реактивными, они активно взаимодействуют с другими веществами. Например, они образуют ионы положительного заряда, формула которых соответствует конфигурации газа благородного элемента, имеющего полностью заполненные электронные подуровни.
Общая электронная формула щелочных металлов 1s2 2s2 2p6 3s1 позволяет объяснить их химические свойства и поведение в различных реакциях. Малая энергия ионизации позволяет этим металлам быстро и легко отдавать свой внешний электрон, что делает их основными элементами для различных промышленных процессов и химических реакций.
Важность электронной формулы для химических свойств щелочных металлов
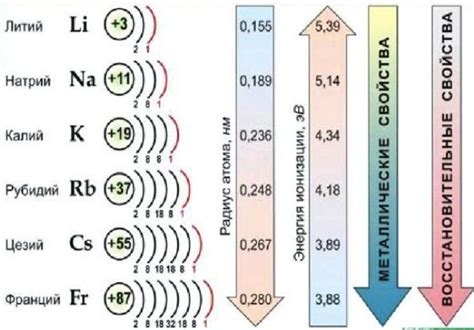
Электронная формула представляет собой запись, отражающую электронную конфигурацию атома щелочного металла. Данная формула имеет важное значение для понимания химических свойств данных элементов.
Из электронной формулы можно узнать количество электронов в разных энергетических уровнях атома щелочного металла. Например, в электронной формуле натрия Na (1s^2 2s^2 2p^6 3s^1) стоит указание, что на внешнем энергетическом уровне находится один электрон. Такая информация позволяет предсказывать химические реакции и химическую активность щелочных металлов.
Величина и направленность электронного движения в атомах щелочных металлов определяется их электронной формулой. Знание электронной конфигурации позволяет понять, почему щелочные металлы обладают высокой химической активностью и способностью образовывать ионы с положительным зарядом.
Также, электронная формула позволяет определить положение элемента в периодической системе. Натрий, калий и другие щелочные металлы расположены в первой группе периодической системы, что объясняется наличием одного электрона на внешнем энергетическом уровне.
В заключение, электронная формула щелочных металлов необходима для полного понимания их химических свойств. Она позволяет предсказывать реакционную способность и химическую активность данных элементов, а также определять их положение в периодической системе.
Вопрос-ответ

Чем отличается электронная формула щелочного металла от электронной формулы других элементов?
Электронная формула щелочного металла отличается от электронной формулы других элементов тем, что у щелочных металлов наиболее заполненная энергетическая оболочка состоит всего из одного электрона. В данном случае электронная формула 1s2 2s2 2p6 3s3 означает, что на внешней энергетической оболочке у щелочного металла находится 3 электрона.
Какие еще элементы могут иметь похожую электронную формулу на щелочный металл?
Похожую электронную формулу на щелочный металл 1s2 2s2 2p6 3s3 могут иметь элементы, которые находятся в том же периоде и имеют аналогичные электронные конфигурации. Например, элементы второй группы (BCNOF) имеют электронные формулы, в которых на внешней энергетической оболочке находится 2 или 3 электрона, а значит, их электронные формулы будут похожи на электронную формулу щелочного металла.
