Электронная формула металлов является важным инструментом для представления внутренней структуры атомов металлов и их поведения при взаимодействии с другими элементами. Она основана на принципах квантовой механики и определяет распределение электронов по энергетическим уровням и подуровням в атоме металла.
Основной элемент электронной формулы металла - это название элемента и его порядковый номер, который указывает на количество электронов в атоме. Например, у железа атомный номер 26, что означает наличие 26 электронов в его атоме.
Далее, электроны в атоме металла распределяются по энергетическим уровням и подуровням. Энергетические уровни обозначаются числами 1, 2, 3 и т.д., а подуровни - буквами s, p, d, f. Например, электронная формула железа может выглядеть так: 1s2 2s2 2p6 3s2 3p6 4s2 3d6. Это означает, что у железа на первом энергетическом уровне находится 2 электрона, на втором - 8 электронов, на третьем - 14 электронов, а на четвертом - 6 электронов.
Электронная формула металла позволяет предсказать его химические свойства и реакционную способность. Она позволяет определить, сколько электронов доступно для участия в химической реакции, и какие энергетические переходы могут происходить в атоме металла. Это невероятно важная информация для химиков и исследователей, занимающихся изучением металлов и разработкой новых материалов на их основе.
Определение электронной формулы металлов
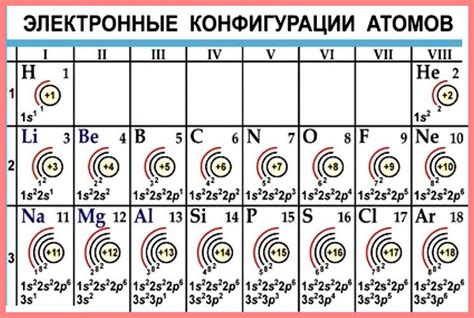
Электронная формула металла используется для описания расположения электронов в электронных оболочках атомов металлов. Она позволяет определить количество электронов на каждом энергетическом уровне и их распределение по подуровням.
Электронная формула металла следует правилу заполнения электронных оболочек, которое устанавливает порядок заполнения энергетических уровней и подуровней. Сначала заполняются энергетические уровни с наименьшей энергией, а затем постепенно переходят к уровням с более высокой энергией.
Каждый энергетический уровень в электронной формуле металла обозначается числом (1, 2, 3 и т.д.), а каждый подуровень обозначается буквами s, p, d, f. Например, s-подуровень обладает наименьшей энергией, а f-подуровень - наибольшей. Также в электронной формуле указывается количество электронов, находящихся на каждом энергетическом уровне и подуровне.
Электронная формула металлов позволяет анализировать химические свойства и реактивность металлов, а также предсказывать их способность образовывать соединения и взаимодействовать с другими веществами.
Принципы составления электронной формулы металлов
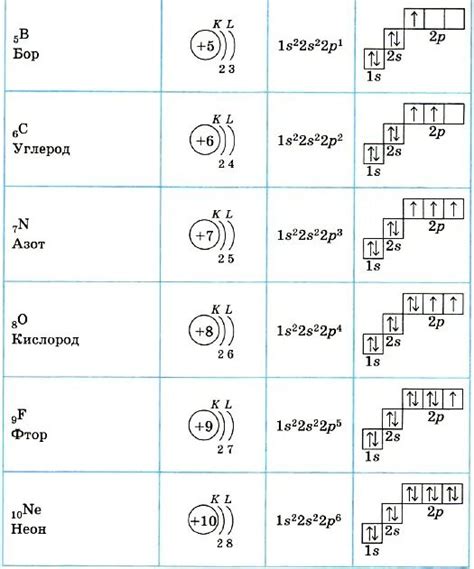
Электронная формула металлов - это способ представления распределения электронов в энергетических уровнях атомов металлов. Она позволяет описать строение атомов металлов и понять их химические свойства.
Составление электронной формулы металлов основано на электронной конфигурации атома металла. Электронная конфигурация определяет распределение электронов по энергетическим уровням и подуровням атома.
Первый принцип составления электронной формулы металлов связан с заполнением энергетических уровней. Электроны заполняют уровни по порядку возрастания энергии, начиная с наименьшего. На каждом уровне могут находиться определенное число электронов.
Второй принцип составления электронной формулы металлов связан с заполнением подуровней. Каждый энергетический уровень состоит из нескольких подуровней, обозначаемых буквами s, p, d, f. Подуровни заполняются в определенном порядке: сначала заполняются подуровни s, затем p, d и f.
Третий принцип составления электронной формулы металлов связан с правилом Хунда. Правило Хунда гласит, что электроны в подуровне заполняются по принципу максимального мультиплицирования спинового состояния. Это означает, что на одном энергетическом уровне сначала заполняются все подуровни с одним спиновым состоянием, а затем - с другим.
Для составления электронной формулы металлов можно использовать таблицу Менделеева, которая показывает электронную конфигурацию атомов всех элементов. Также можно использовать правила заполнения электронных уровней и подуровней.
Важность электронной формулы металлов в химии

Электронная формула металлов является ключевым инструментом для анализа и понимания химических свойств и поведения металлических элементов. Она представляет собой систематическое описание распределения электронов во внешних оболочках атомов, что позволяет определить множество химических свойств металлов.
Электронная формула металлов основана на распределении электронов по энергетическим уровням и подуровням атомов. Она позволяет понять, как металлы взаимодействуют с другими веществами, как они образуют связи и какие химические реакции они могут претерпеть. Важно отметить, что электронная формула металлов также позволяет определить электронную конфигурацию, которая определяет металлические свойства, такие как проводимость электричества и тепла, пластичность и магнитные свойства.
Кроме того, электронная формула металлов позволяет предсказывать и объяснять свойства соединений, образованных металлами. Например, зная электронную формулу металла и формулу его соединения с другим элементом, можно определить тип связи и химические свойства этого соединения. Это важно для проведения химических реакций и разработки новых материалов с улучшенными свойствами.
Таким образом, электронная формула металлов играет ключевую роль в химии, позволяя понять и объяснить множество химических свойств и взаимодействий металлов, а также предсказать химические реакции и свойства соединений, в которых они участвуют. Это делает ее необходимым инструментом для исследований и разработки новых материалов, а также для применений в различных областях науки и техники.
Практическое применение электронной формулы металлов
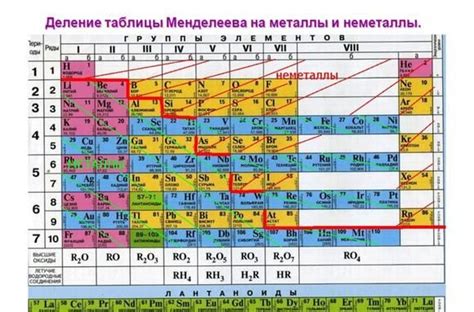
Электронная формула металлов является основой для понимания и изучения их свойств и поведения. Знание количества и распределения электронов в атоме металла позволяет предсказывать его химическую активность и способность образовывать соединения.
Основные области практического применения электронной формулы металлов включают:
- Методы синтеза и обработки материалов: Электронная формула металлов позволяет оптимизировать процессы синтеза металлических материалов и определить оптимальные условия обработки и формирования структуры материалов.
- Материальная наука: Изучение электронной формулы металлов способствует разработке новых металлических материалов с определенными свойствами, таких как прочность, теплопроводность, проводимость электричества и другие.
- Каталитические процессы: Электронная формула металлов позволяет исследовать каталитические свойства металлов и разрабатывать новые катализаторы для химических и энергетических процессов.
- Электроника и электротехника: Знание электронной формулы металлов необходимо для разработки и проектирования электронных устройств и микросхем.
- Медицина и биология: Понимание электронной формулы металлов помогает выбирать оптимальные металлы и их соединения для использования в медицинских протезах, инструментах и лекарственных препаратах.
Все эти области являются важными для развития промышленности и науки, и практическое применение электронной формулы металлов способствует развитию новых технологий и материалов.
Вопрос-ответ

Какие принципы составления электронной формулы металлов?
Электронная формула металлов составляется на основе расположения электронов в атомах металлов и их энергетических уровней. Основной принцип состоит в заполнении энергетических уровней электронами с наименьшей энергией. Важно также учитывать правила заполнения орбиталей по принципу «кисетной схемы» и правила Хунда – «наименьшего энергетического расхода».
Как можно расположить электроны на энергетических уровнях?
При составлении электронной формулы металлов электроны располагаются на энергетических уровнях по возрастанию их энергии. Сначала заполняются электроны на первом энергетическом уровне, затем на втором и так далее. Электроны на одном энергетическом уровне заполняют орбитали по принципу «кисетной схемы», где сначала заполняются все орбитали с противоположным спином, а затем с тем же спином.
Какие законы и правила нужно учитывать при составлении электронной формулы металлов?
Учитываются принцип заполнения орбиталей по правилу Хунда и правила заполнения электронных орбиталей по принципу «кисетной схемы». Правило Хунда гласит, что электроны будут заполнять всё новые орбитали с одинаковым спином, пока не будут заняты все орбитали. Правило заполнения орбиталей по принципу «кисетной схемы» гласит, что орбитали заполняются таким образом, чтобы все орбитали с противоположным спином были заполнены перед заполнением орбиталей с тем же спином.
