Активные металлы - это элементы, которые легко вступают в химические реакции и обладают высокой реакционной способностью. Они находятся в первой и второй группе периодической системы, таких как литий, натрий, калий, магний и др. Они имеют специфическую электронную формулу, которая помогает объяснить их химические свойства и взаимодействия с другими веществами.
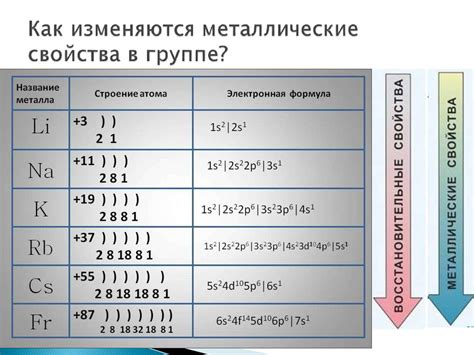
Электронная формула активного металла показывает его электронную конфигурацию, то есть количество электронов в различных энергетических уровнях атома. Например, электронная формула для лития может быть представлена как 1s2 2s1. Это означает, что в литиевом атоме на первом энергетическом уровне находятся 2 электрона, а на втором - 1 электрон. Это способствует высокой реакционной способности лития, поскольку второй энергетический уровень не полностью заполнен.
Активные металлы хорошо известны своими химическими свойствами, такими как сильная реакция с кислородом, образование щелочных растворов при реакции с водой, образование солей и многие другие. Эти свойства связаны с электронной формулой активного металла и его способностью легко отдавать или принимать электроны. Например, литий очень реакционен с водой, образуя гидроксид лития и выделяя водород. Это связано с тем, что литий легко отдает свой электрон на втором энергетическом уровне, образуя ион Li+. В итоге, его электронная формула становится 1s2 без электрона на втором энергетическом уровне.
Активный металл: электронная формула и свойства

Активный металл - это элемент химической таблицы, обладающий высокой реактивностью и способностью легко образовывать стабильные соединения с другими элементами. Такие металлы обычно находятся слева от таблицы и имеют малое количество электронов во внешней электронной оболочке.
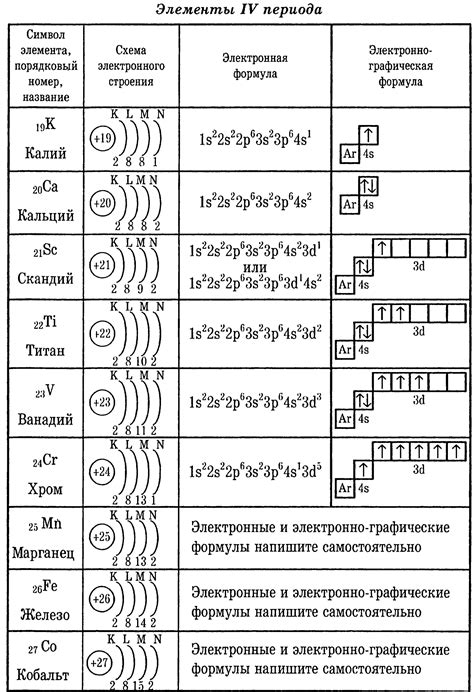
Электронная формула активного металла обычно представляет собой символ элемента, за которым указывается количество электронов в каждой оболочке. Например, электронная формула натрия (Na) - 2.8.1, что означает, что у него имеется 2 электрона в первой оболочке, 8 электронов во второй оболочке и 1 электрон во внешней третьей оболочке.
Свойства активных металлов определяются их электронной формулой. Так, благодаря наличию одного или двух электронов во внешней оболочке, активные металлы обладают высокой электроотрицательностью и способностью образовывать ионы с положительным зарядом. Они также активно реагируют с кислородом, водой и другими веществами, выпуская при этом энергию.
Активные металлы широко используются в различных отраслях промышленности и науки. Например, натрий применяется для производства щелочей, алюминий - для изготовления легких конструкций, магний - для создания сплавов с высокой прочностью.
Важно отметить, что из-за высокой реактивности активные металлы обычно хранятся под слоем инертного газа или в вакууме, чтобы предотвратить их взаимодействие с воздухом и влагой. Кроме того, при работе с активными металлами необходимо соблюдать специальные меры безопасности, так как они могут быть взрывоопасными и ядовитыми.
Сущность активного металла
Активный металл - это металл, обладающий высокой реактивностью и способностью активно вступать в химические реакции.
Основные свойства активных металлов включают:
- Высокую реактивность: активные металлы легко вступают в химические реакции с другими веществами, особенно с кислородом и водой.
- Способность образовывать ионы: активные металлы могут потерять электроны, образуя положительно заряженные ионы.
- Высокую электропроводность: активные металлы обладают высокой способностью проводить электрический ток.
- Низкую температуру плавления: многие активные металлы имеют низкую температуру плавления, что делает их легко плавить и применять в различных процессах.
Активные металлы широко используются в различных областях, включая производство батареек и аккумуляторов, строительство, производство сплавов и многие другие. Однако, из-за своей реактивности они также могут быть опасными, особенно при неправильном обращении с ними.
Примерами активных металлов являются литий (Li), натрий (Na), калий (K), магний (Mg) и алюминий (Al). Все эти металлы обладают высокой химической активностью и широко используются в различных отраслях промышленности и научных исследованиях.
Важность электронной формулы
Электронная формула активного металла является важным инструментом для понимания его свойств и химической активности. Электронная формула показывает расположение электронов в атоме металла и помогает предсказать, как он будет реагировать с другими веществами.
Электроны внешней оболочки активного металла играют ключевую роль в его реактивности. Благодаря электронной формуле можно определить количество электронов во внешней оболочке и, следовательно, предугадать, как активный металл взаимодействует с другими веществами.
Изучение электронной формулы активного металла также позволяет определить его возможное окислительное число. Окислительное число указывает на способность металла отдавать электроны в реакциях, что в свою очередь указывает на его химическую активность.
Электронная формула активного металла также помогает предсказать, какой тип реакции может произойти при его взаимодействии с другими веществами. Например, на основе электронной формулы можно предсказать, что активный металл может реагировать с водой и образовывать основание, что служит основой для понимания его применения в различных областях, таких как производство гидроксидов и лекарств.
В итоге, электронная формула активного металла является важной информацией для понимания его свойств, реакций и возможных применений. Изучение электронной формулы помогает расширить знания о химических взаимодействиях и может иметь практическое применение в различных областях науки и технологии.
Электронная формула активного металла
Электронная формула активного металла представляет собой способ записи расположения электронов в его атоме. Она позволяет визуально представить структуру атома и определить количество электронов на каждом энергетическом уровне.
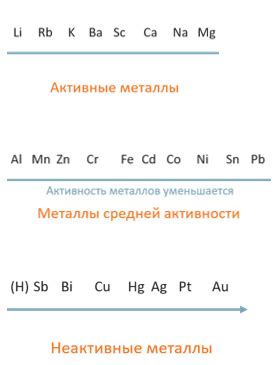
Металлы являются активными элементами, так как у них относительно низкая энергия ионизации. Это обозначает, что они с легкостью могут отдавать электроны и образовывать ионы положительного заряда. Активные металлы находятся в левой части периодической таблицы.
Примером активного металла может служить натрий, обозначаемый символом Na. Его электронная формула выглядит так: 1s2 2s2 2p6 3s1. Здесь цифры означают количество электронов на каждом энергетическом уровне. Иногда электронную формулу можно представить в виде диаграммы, где маленькие кружочки обозначают электроны, а стрелки показывают их направление.
Электронная формула активного металла позволяет увидеть, что на внешнем энергетическом уровне у натрия находится один электрон. Это делает его активным, так как он готов образовывать ионы, отдавая этот электрон и становясь положительно заряженным.
Таким образом, электронная формула активного металла помогает понять его возможности для образования химических соединений и его свойства. Она является важным инструментом для изучения и понимания химии активных металлов.
Химические свойства активных металлов
Активные металлы - это элементы из группы I и II периодической системы, такие как литий (Li), натрий (Na), калий (K), магний (Mg) и другие. Они отличаются высокой реакционной способностью и легко образуют ионные соединения с неметаллами.
Одним из основных свойств активных металлов является их способность реагировать с водой. Например, натрий реагирует с водой, выделяя водород и образуя гидроксид натрия (NaOH). Реакция активных металлов с водой может быть очень быстрой и сопровождаться выделением тепла и пламени.
Активные металлы также обладают способностью реагировать с кислородом воздуха. Когда металлы окисляются, образуются соответствующие оксиды. Например, магний горит в воздухе, образуя оксид магния (MgO). Этот процесс называется горением металлов и сопровождается ярким пламенем.
Еще одним важным химическим свойством активных металлов является их способность реагировать с кислотами. При взаимодействии металлов с кислотами образуются соли и выделяется водород. Например, реакция натрия с соляной кислотой приводит к образованию хлорида натрия (NaCl) и выделению водорода (H2). Эта реакция является типичным примером нейтрализационной реакции.
Кроме того, активные металлы обладают высокой электрохимической активностью и легко образуют ионные соединения с другими элементами. Это свойство активных металлов находит широкое применение в различных областях науки и промышленности, включая производство батареек, сплавов и лекарственных средств.
Физические свойства активных металлов
1. Периодическая таблица
Активные металлы находятся в левой части периодической таблицы. Они включают группы 1 (щелочные металлы) и 2 (щелочноземельные металлы). Эти элементы характеризуются высокой химической реактивностью и низкой электроотрицательностью.
2. Мягкость
Активные металлы обычно обладают низкой твердостью и мягкостью. Например, натрий (Na) может быть нарезан ножом или легко раздавлен пальцами. Это связано с тем, что атомы активных металлов образуют кристаллическую решетку с большими промежутками, что делает их мягкими и легко деформируемыми.
3. Низкая плотность
Активные металлы обладают низкой плотностью из-за простого строения и больших промежутков в кристаллической решетке. Например, литий (Li) имеет очень низкую плотность и является наименее плотным элементом в периодической таблице.
4. Высокая температура плавления
Многие активные металлы обладают высокой температурой плавления. Например, калий (K) плавится при температуре около 63°C, что является достаточно высокой температурой для металла. Это связано с тем, что атомы активных металлов образуют крепкие межатомные связи, которые требуют высокой энергии для разрушения.
5. Хорошая теплопроводность и электропроводность
Активные металлы обладают хорошей теплопроводностью и электропроводностью. Это связано с легкостью передвижения свободных электронов в кристаллической решетке. Например, алюминий (Al) и медь (Cu) являются отличными проводниками электричества и тепла.
Взаимодействие активного металла с другими веществами

Активные металлы, такие как натрий, калий и литий, обладают высокой реакционной способностью и легко взаимодействуют с другими веществами. Они реагируют с водой, кислородом, неметаллами и некоторыми органическими соединениями.
Самым известным и распространенным примером взаимодействия активного металла с веществом является реакция с водой. При контакте со свежеприготовленным натрием или калием вода начинает активно пузыриться, выделяться газ и растворяться металл. Это связано с формированием гидроксидов металлов и выделением водорода. Реакция с водой является достаточно быстрой и высвобождающийся газ можно поджечь.
Активные металлы также реагируют с кислородом воздуха. При нагревании или длительном хранении активного металла на воздухе на его поверхности образуется окисленное покрытие, которое препятствует дальнейшему взаимодействию с кислородом. При удалении окисленного слоя активный металл начинает гореть с ярким пламенем, образуя оксид металла.
Взаимодействие активного металла с неметаллами, такими как сера или халогены, также является характерным для этих элементов. Например, при смешивании активного металла с серой и нагревании происходит реакция, в результате которой образуется сульфид металла. Реакция между активным металлом и хлором приводит к образованию хлорида металла.
Активные металлы также могут реагировать с некоторыми органическими соединениями. Например, реакция между активным металлом и спиртами приводит к образованию соответствующих органических солей или алкоксидов. Такие реакции широко используются в органическом синтезе для получения различных соединений.
Применение активных металлов

Активные металлы широко применяются в различных отраслях промышленности благодаря их уникальным свойствам. Например, натрий используется в производстве стали и алюминия, а также в химической промышленности для синтеза различных соединений.
Калий, в свою очередь, является важным компонентом удобрений, что делает его неотъемлемым элементом в сельском хозяйстве. Калийные удобрения способствуют росту и развитию растений, а также повышают урожайность.
Литий широко применяется в производстве аккумуляторов, особенно в мобильных телефонах и электрических автомобилях. Благодаря низкому весу и высокой энергоемкости, литиевые аккумуляторы обеспечивают длительное время работы и быструю зарядку.
Рубидий используется в научных и медицинских приборах, а также в оптической промышленности для создания лазеров. Рубидиевые лазеры отличаются большой мощностью и высокой точностью, что позволяет использовать их в различных областях науки и техники.
Цезий применяется в атомных часах, где его стабильные изотопы используются для точного измерения времени. Атомные часы с цезиевыми источниками являются основой для определения международного времени и являются неотъемлемой частью современной технологии связи и навигации.
Вопрос-ответ

Какая электронная формула у активного металла?
Электронная формула активного металла зависит от его атомного номера. Обычно активные металлы имеют одну или две валентные электроны в последней оболочке. Например, натрий имеет электронную формулу 1s^2 2s^2 2p^6 3s^1, а литий - 1s^2 2s^1.
Какие свойства обладает активный металл?
Активные металлы обладают рядом характерных свойств. Они реагируют с водой, кислородом и другими неметаллами, образуя щелочные оксиды и гидроксиды. Активные металлы легко окисляются и могут вступать в реакции с кислородом, серой и другими веществами. Они обладают низкой плотностью и низкой температурой плавления.
