Когда мы говорим о металлах, немедленно всплывают в памяти ассоциации с блеском, проводимостью электричества и тепла, а также активностью. Среди всех металлов, наиболее активным и реактивным является металл, находящийся в левом углу периодической системы - франций (Fr). Этот элемент обладает необычной электронной структурой, которая объясняет его высокую активность.
Франций имеет атомный номер 87 и находится в первой группе периодической системы. Это означает, что он имеет одну валентную электрон. Однако, представление его электронной формулы в виде 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s1 не совсем точно. В действительности, франций обладает самой низкой энергией ионизации из всех известных элементов и его валентную электрон можно представить как "плавающий" вокруг ядра атома.
Такая электронная структура делает франций нестабильным и очень реактивным металлом. Он легко вступает в химические реакции с другими элементами, находящимися в его окружении, и даже с воздухом и водой. Франций также обладает высокой электроотрицательностью, что означает, что он сильно удерживает свою валентную электрон и легко отдает его другим элементам, что делает его отличным источником электронов в различных химических реакциях.
В заключение, электронная формула франция, наиболее активного металла, отличается от формулы большинства других элементов. Его низкая энергия ионизации и высокие электроотрицательность делают его реактивным и химически активным. Франций проявляет способность к легкому обмену валентными электронами, что помогает ему взаимодействовать с другими элементами и вступать в различные химические реакции.
Металлы

Металлы - это химический элемент, обладающий определенными свойствами, такими как хорошая электропроводность, теплопроводность, пластичность и глянцевая поверхность. Они образуют большую группу в периодической таблице элементов, состоящую из различных металлических элементов.
У металлов обычно высокие температуры плавления и кипения, и они часто образуют кристаллическую решетку при образовании твердого состояния. Многие металлы также обладают химической реактивностью, что позволяет им образовывать соединения с другими элементами и ионами.
Металлы находят широкое применение в различных отраслях промышленности и технологии. Они используются для производства различных материалов, таких как сталь, алюминий, медь и железо. Многие металлы также используются в электронике и электротехнике, благодаря своим электропроводным свойствам.
В периодической таблице металлы обычно расположены слева и по середине, включая щелочные металлы, щелочноземельные металлы, переходные металлы и металлы пятой до десятой группы. Однако группы также могут содержать не все металлы, а некоторые из них могут входить в несколько групп одновременно.
Химические элементы во всей своей красе
Химические элементы — это основные строительные блоки материи. Каждый элемент представлен своей уникальной химической формулой, которая указывает на его атомный состав. Они разнообразны и удивительны: от благородных газов до крайне реакционных металлов.
Наиболее активные металлы, такие как натрий, калий и литий, относятся к группе алкалий. Они отличаются высокой реакционностью и способностью быстро связываться с другими элементами. Атомы этих металлов обладают всего одним электроном на внешней энергетической оболочке, что делает их нестабильными и склонными к реакциям.
Электронная формула наиболее активного металла, лития, имеет запись 1s²2s¹. Здесь "1s²" означает, что на первой энергетической уровне находятся 2 электрона, а "2s¹" означает, что на втором энергетическом уровне находится всего 1 электрон. Такая конфигурация делает литий очень реакционным и приводит к его активному взаимодействию с другими веществами.
Однако, каждый элемент имеет свою уникальную электронную формулу. Некоторые элементы, например, железо (Fe), имеют более сложные электронные конфигурации. Не смотря на это, все химические элементы вносят свой вклад в разнообразие мира, обладая уникальными свойствами и образуя различные соединения.
Физические и химические свойства металлов

Физические свойства металлов
Металлы обладают несколькими характерными физическими свойствами. Одним из них является высокая плотность, что делает их тяжелыми и устойчивыми в различных условиях.
Металлы обладают высокой теплопроводностью. Они способны передавать тепло от одной точки к другой, что делает металлы отличными материалами для использования в различных теплопередающих устройствах.
Металлы также обладают хорошей электропроводностью. Они могут передавать электрический ток без сопротивления, что делает их незаменимыми для создания электрических проводов и схем.
Химические свойства металлов
Химические свойства металлов также являются важными и определяют их способность реагировать с другими веществами. Металлы могут вступать в реакцию с кислородом, образуя оксиды металлов.
Многие металлы могут растворяться в кислотах, образуя соли и выделяя водород. Они также могут реагировать с щелочами, образуя основания и выделяя водород.
Металлы позволяют проводить электролиз, то есть разложение воды на водород и кислород при прохождении электрического тока через него.
Также металлы могут образовывать сплавы с другими металлами, что расширяет их использование в различных отраслях промышленности.
Строение атома металла
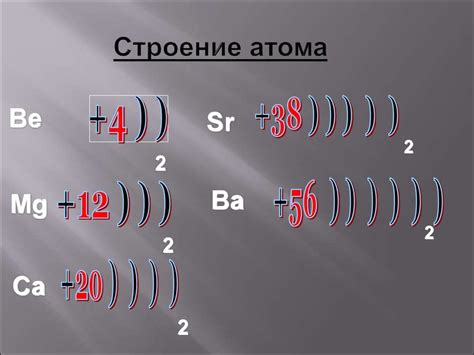
Атом металла представляет собой особую структуру, состоящую из ядра и облака электронов. В ядре атома находятся протоны и нейтроны, которые численно равны атомному номеру металла. Протоны обладают положительным зарядом, а нейтроны - не имеют заряда. Вместе они создают положительно заряженное ядро.
Облако электронов, в свою очередь, представляет собой область пространства вокруг ядра, где располагаются электроны. Количество электронов определяется атомным номером и равно числу протонов в ядре. Электроны обладают отрицательным зарядом и движутся вокруг ядра по энергетическим оболочкам или орбитам.
Наиболее активные металлы имеют одну электрон на своей внешней энергетической оболочке. Это делает их нестабильными и склонными к химическим реакциям. Для достижения стабильности, атомы металла стремятся отдать этот внешний электрон другим атомам. Отдача электрона приводит к образованию положительно заряженного иона, что позволяет металлам проявлять металлические свойства, такие как хорошая теплопроводность и электропроводность.
Таким образом, строение атома металла определяет его активность и химические свойства. Внешний электрон, находящийся на последней энергетической оболочке, играет решающую роль во взаимодействии металла с другими веществами и в формировании металлической структуры.
Электронная оболочка атома металла
Атомы металлов вещества состоят из ядра и электронной оболочки. Ядро атома содержит протоны и нейтроны, а электронная оболочка содержит электроны.
Данные о распределении электронов по электронным оболочкам записываются в электронной формуле атома. Эта формула показывает, на какие уровни энергии распределены электроны и сколько их на каждом уровне.
Электронная формула атома металла может быть представлена с использованием символов и цифр. Каждый электрон обозначается символом, например, буквой "e", а каждая электронная оболочка обозначается цифрой: 1, 2, 3 и т.д.
Электронная оболочка атома металла может иметь несколько уровней энергии. На первом уровне энергии может находиться только 2 электрона, на втором - до 8 электронов, на третьем - до 18 электронов и так далее.
В электронной формуле атома металла количество электронов на каждом уровне обозначается строчными буквами названия периода, в котором находится данный уровень энергии. Например, атом металла, у которого 2 электрона на первом уровне энергии и 8 электронов на втором уровне энергии, будет иметь электронную формулу "2e18e2".
Электронная формула: ключ к активности металла
Активность металла является одной из его основных характеристик, определяющей его поведение и способность взаимодействовать с другими веществами. Одним из ключевых инструментов для понимания активности металла является его электронная формула.
Электронная формула металла представляет собой запись его электронной конфигурации – расположения электронов на энергетических уровнях. Она позволяет определить количество внешних электронов, так называемых валентных электронов, которые играют ключевую роль в химическом взаимодействии. Чем больше валентных электронов у металла, тем он более активен.
Активность металла определяется его способностью отдавать или принимать электроны при взаимодействии с другими веществами. Металлы с малым количеством валентных электронов обычно имеют большую активность, поскольку они стремятся избавиться от своих электронов и стать положительно заряженными ионами. Напротив, металлы с большим количеством валентных электронов имеют меньшую активность, так как им сложнее расстаться со своими электронами.
Знание электронной формулы металла позволяет прогнозировать его активность и предсказывать возможные реакции при взаимодействии с другими веществами. Например, металлы с малым количеством валентных электронов обычно легко реагируют с кислородом, образуя окислы, в то время как металлы с большим количеством валентных электронов могут образовывать ионы с разными степенями окисления.
Таким образом, электронная формула является неотъемлемым инструментом в химии и позволяет исследовать и понимать активность металлов, их свойства и возможности реакций с другими веществами. Она является ключевым элементом в изучении и прогнозировании химических процессов и явлений, связанных с металлами.
Процесс формирования электронной формулы

Электронная формула наиболее активного металла отражает расположение электронов в его атоме и помогает понять его химические свойства. Для формирования электронной формулы необходимо знать количество электронов в атоме металла и его электронную конфигурацию.
Первым шагом в процессе формирования электронной формулы является определение общего числа электронов в атоме металла. Для этого необходимо знать номер элемента в периодической системе Менделеева. Например, калий имеет атомный номер 19, что означает наличие 19 электронов в его атоме.
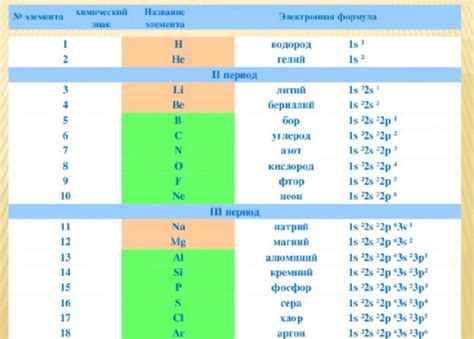
Далее необходимо распределить электроны по энергетическим уровням и подуровням атома металла в соответствии с его электронной конфигурацией. Например, электронная конфигурация калия: 1s²2s²2p⁶3s²3p⁶4s¹. Это означает, что первый энергетический уровень заполнен 2 электронами, второй - 8 электронами и третий - 1 электроном.
Заключительным шагом является запись электронной формулы. Обычно электроны каждого энергетического уровня и подуровня указывают с помощью символа, обозначающего название нижележащего энергетического уровня, и верхнего индекса, указывающего количество электронов на данном уровне. Например, электронная формула калия будет выглядеть: 1s²2s²2p⁶3s²3p⁶4s¹.
Таким образом, процесс формирования электронной формулы наиболее активного металла включает определение общего числа электронов, распределение электронов по энергетическим уровням и запись электронной формулы.
Наиболее активные металлы и их электронные формулы
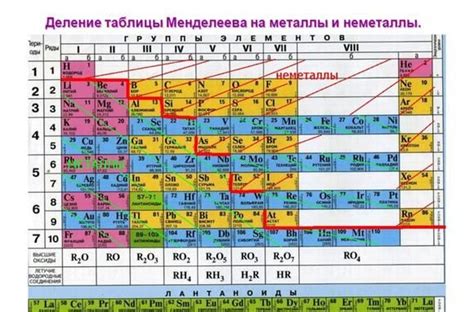
Металлы могут иметь разную активность в зависимости от их химических свойств и положения в периодической таблице. Наиболее активные металлы расположены в левой верхней части таблицы и относятся к группе щелочных металлов. Их электронные формулы позволяют определить степень их активности и химическую реакционность.
Натрий (Na) - один из наиболее активных металлов, его электронная формула: 1s2 2s2 2p6 3s1. Натрий легко окисляется воздухом и реагирует с водой, образуя щелочную реакцию.
Калий (K) также относится к наиболее активным металлам. Его электронная формула: 1s2 2s2 2p6 3s2 3p6 4s1. Калий может взрываться при контакте с водой и реагировать с кислородом из воздуха.
Литий (Li) также является наиболее активным металлом с электронной формулой: 1s2 2s1. Литий реагирует с водой, образуя щелочную реакцию, и может образовывать соединения с кислородом.
Цезий (Cs) и франций (Fr) также относятся к наиболее активным металлам, но они являются редкими и малоизученными элементами. Электронные формулы цезия и франция представляют собой сложные комбинации электронов.
Наиболее активные металлы часто используются в различных химических реакциях и процессах, таких как производство щелочей, реакции с водой, а также в качестве катализаторов и добавок в металлургии.
Вопрос-ответ

Какая электронная формула наиболее активного металла?
Электронная формула наиболее активного металла - K
Почему электронная формула K является наиболее активной для металла?
Электронная формула K является наиболее активной для металла, потому что в ее внешней электронной оболочке находится один электрон, что делает этот металл готовым к активному взаимодействию с другими веществами
Какие еще элементы имеют похожую электронную формулу, но менее активны?
Имеют похожую электронную формулу, но менее активны, элементы с электронными формулами Ca, Na, Rb, Cs, Fr
