Активные металлы представляют собой группу элементов, которые обладают высокой химической реактивностью и легко образуют ионные соединения. Один из самых активных металлов – калий. Его атомная структура и электронная формула являются основой для понимания его активности и химических свойств.
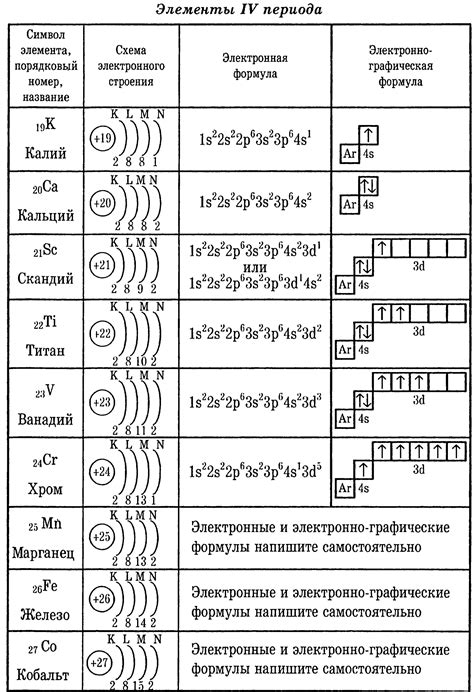
Калий принадлежит к первой группе периодической системы элементов и имеет атомный номер 19. Это означает, что в атоме калия наличествует 19 электронов. По своей электронной формуле, калий имеет 2 электрона в первом энергетическом уровне (с энергией 2) и 8 электронов во втором энергетическом уровне (с энергией 8). Оставшиеся 8 электронов находятся в третьем энергетическом уровне (с энергией 9).
Электронная конфигурация калия можно записать как 1s2 2s2 2p6 3s2 3p6 4s1
Электронная формула атома калия позволяет нам понять его активность. Последний электрон находится в четвёртом энергетическом уровне – наружной оболочке, и просто сняться от неё. Этот электрон является валентным электроном калия и определяет химическую активность этого элемента. Именно благодаря наличию одного валентного электрона, калий проявляет высокую активность при вступлении в химические реакции.
Обзор электронной формулы атома наиболее активного металла

Электронная формула атома наиболее активного металла отражает его устройство и расположение электронов в оболочках. Наиболее активные металлы находятся в первой группе периодической таблицы элементов, таких как литий (Li), натрий (Na) и калий (K).
В электронной формуле атома наиболее активного металла обозначаются оболочки и количество электронов в каждой оболочке. Например, у атома лития внешняя оболочка содержит 1 электрон, поэтому его электронная формула Li будет выглядеть как 2-1.
Наиболее активные металлы имеют один электрон во внешней оболочке, что делает их склонными к отдаче этого электрона и образованию ионов положительной зарядности. Это объясняет их реактивность и способность взаимодействовать с другими веществами.
Электронная формула атома наиболее активного металла позволяет увидеть схему заполнения электронных оболочек и понять, какие элементы могут образовывать ионы при вступлении в химическую реакцию. Это важно для понимания химических свойств и реактивности этих металлов.
Обращаясь к электронной формуле атома наиболее активного металла, ученые и химики могут предсказывать его поведение в реакциях и использовать эту информацию для создания новых соединений и материалов с определенными химическими и физическими свойствами.
Определение активного металла и его особенности
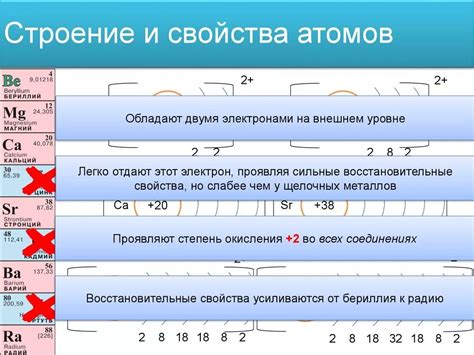
Активные металлы - это элементы, которые вступают в химические реакции с высокой степенью активности. Они обладают способностью легко и быстро образовывать ионы с положительным зарядом, что делает их отличными веществами для электронных формул атомов.
Особенность активных металлов заключается в том, что они легко отдают электроны и образуют ионы с положительным зарядом. Это связано с их электрохимической активностью - способностью вступать в химические реакции с окружающими веществами.
Активные металлы обладают высокой реакционной способностью и обычно реагируют с кислородом, водой и кислотами. Они способны образовывать соли и гидроксиды, которые широко используются в различных отраслях промышленности.
Наиболее активным металлом является калий (K), который входит в группу щелочных металлов. Его электронная формула атома выглядит как 1s2 2s2 2p6 3s2 3p6 4s1 или [Ar] 4s1. Благодаря своей высокой активности, калий широко используется в лабораторных и промышленных процессах, в производстве удобрений и пищевой промышленности.
В общем, активные металлы играют важную роль в различных сферах человеческой деятельности благодаря своей химической активности и способности образовывать положительно заряженные ионы.
Структура атома активного металла и его особенности

Атом активного металла имеет особую структуру, которая влияет на его активность и химические свойства. Основой структуры атома является ядро, в котором находятся протоны и нейтроны. Вокруг ядра движутся электроны по энергетическим уровням.
Уникальной особенностью атомов активных металлов является наличие только одного электрона на внешнем энергетическом уровне. Такой электрон называется валентным, он наиболее свободен и активен в химических реакциях. Валентный электрон может легко участвовать в обмене электронами с другими атомами, что делает активные металлы хорошими восстановителями.
Атомы активных металлов стремятся достичь более стабильной электронной конфигурации, переходя наиболее выгодную степень окисления. Для этого они могут отдавать свой валентный электрон и образовывать позитивно заряженные ионы. Такие ионы обладают высокой реактивностью, что делает активные металлы реактивными и легко взаимодействующими веществами.
Валентный электрон активного металла также определяет его способность образовывать ионы металла с положительной валентностью. Чем легче атом активного металла, тем легче ему отдать свой валентный электрон, образуя одновалентный ион. Это объясняет почему атомы лития, натрия и калия образуют ионы с +1 зарядом.
Особая структура атома активного металла и его способность отдавать валентный электрон объясняют его высокую реактивность и способность к химическим реакциям. Именно благодаря этим свойствам активные металлы широко используются в различных областях промышленности и технологий.
Электронная формула атома и ее значимость

Электронная формула атома является графическим представлением распределения электронов в атоме. Она позволяет представить, как расположены электроны в различных энергетических уровнях и подуровнях атома. Формула состоит из символов, обозначающих электроны во внутренних и внешних оболочках атома, а также указывает на их количество.
Значимость электронной формулы заключается в том, что она позволяет определить основные свойства атома, его химическое поведение, и его возможность образовывать химические соединения. По формуле можно определить валентность атома и его способность участвовать в химических реакциях.
Основу электронной формулы составляют энергетические уровни и подуровни атома. Уровни обозначаются цифрами (1, 2, 3 и т.д.), а подуровни - латинскими буквами (s, p, d, f). Символы обозначающие электроны располагаются на соответствующих энергетических уровнях и подуровнях. Например, электрон на внешнем энергетическом уровне обозначается буквой ns, где n - номер энергетического уровня, а s - обозначение подуровня s.
Электронная формула атома наиболее активного металла показывает особенности его строения. Наиболее активные металлы находятся на крайнем левом столбце периодической системы и имеют один или два электрона на внешнем энергетическом уровне. Такие металлы стремятся отдать эти электроны для образования ионов, имеющих положительный заряд. Например, электронная формула атома натрия (Na) будет выглядеть как 1s^2 2s^2 2p^6 3s^1, где с помощью цифр и символов обозначены электроны на каждом энергетическом уровне и подуровне.
Связь электронной формулы и активности металла
Электронная формула атома наиболее активного металла определяет его химические свойства и степень его активности. Активность металла зависит от его валентности, то есть количества электронов во внешней оболочке атома.
Наиболее активные металлы расположены в левой части периодической системы элементов и имеют внешнюю оболочку с одним или двумя электронами. Низкая энергия ионизации позволяет им легко отдавать эти электроны, что делает их очень реактивными.
Электронная формула металла представляет собой запись его электронной конфигурации, указывающую, сколько электронов находится в каждом энергетическом уровне. Например, электронная формула натрия (Na) - 2,8,1, что означает, что у атома натрия 2 электрона на первом уровне, 8 электронов на втором уровне и 1 электрон на третьем уровне.
Именно наличие одного электрона во внешней оболочке делает натрий наиболее активным металлом. Он легко отдаёт этот электрон, образуя ион Na+, который вступает в реакцию с другими веществами. Натрий активно реагирует с водой, кислородом, хлором и другими веществами, проявляя свою высокую активность.
Вопрос-ответ

Какая электронная формула атома наиболее активного металла?
Электронная формула наиболее активного металла - 1s² 2s² 2p⁶ 3s² 3p⁶ 4s¹
Какие электронные уровни включены в электронную формулу атома наиболее активного металла?
В электронную формулу атома наиболее активного металла включены следующие электронные уровни: K, L, M, N
Какие подуровни электронных оболочек содержит электронная формула атома наиболее активного металла?
Электронная формула атома наиболее активного металла содержит следующие подуровни электронных оболочек: s, p
