Электролиз водного раствора соли некоторого металла – это процесс, при котором под воздействием электрического тока происходит разложение воды на составляющие её элементы – водород и кислород. Однако, при наличии в растворе соли металла, электролиз протекает с образованием металла на катоде.
Во время электролиза на аноде происходит окисление атомов кислорода и их реакция с водой, что приводит к образованию молекулярного кислорода (О2) и ионов кислорода (ОН-). Аналогично, на катоде происходит редукция ионов металла, что приводит к образованию атомов металла, которые агрегируются и получаются 1 моль металла.
Электролиз водного раствора соли некоторого металла является важным методом получения металлов высокой чистоты. Например, электролиз хлорида натрия позволяет получить натрий массовой долей 99,99%. Такой метод также широко используется в промышленности, например, для получения алюминия, цинка и других металлов.
Электролиз водного раствора соли металла: основные этапы процесса
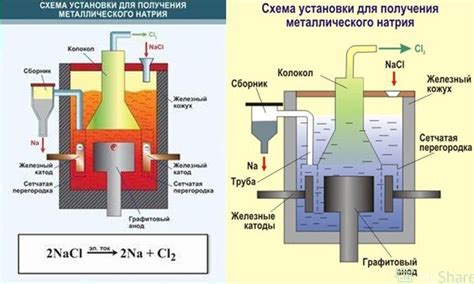
Процесс электролиза водного раствора соли металла состоит из нескольких основных этапов, каждый из которых играет важную роль в процессе получения металла на катоде.
- Подготовка раствора. Перед началом электролиза необходимо приготовить водный раствор соли металла, в котором будут находиться ионы металла и ионы солевой группы. Для этого в воду добавляют определенное количество соли и проводят растворение с помощью перемешивания.
- Установка электролитической ячейки. Второй этап процесса - установка электролитической ячейки, которая состоит из анода и катода, разделенных преградой. Анод представляет собой положительно заряженный электрод, на котором происходит окисление ионы солевой группы, выделяющие свободные электроны. Катод - отрицательно заряженный электрод, на котором осуществляется восстановление металла из ионов металла.
- Проведение электролиза. Третий этап - непосредственно проведение электролиза. При подключении источника постоянного тока электроны с анода перемещаются к катоду, где они участвуют в реакции восстановления металла из ионов металла. На катоде выделяется металл, который затем можно отделить и использовать.
- Контроль параметров процесса. Четвертый этап - контроль ключевых параметров процесса, таких как температура раствора, плотность тока, время проведения электролиза. Правильное настройка этих параметров позволяет достичь желаемого результата и получить нужное количество металла на катоде.
Электролиз водного раствора соли металла - это сложный и многоэтапный процесс, который требует точного контроля и настройки параметров. Благодаря этому процессу становится возможным получение металла на катоде и его последующее использование в различных областях промышленности и научных исследований.
Реализация электролиза в условиях адекватного снабжения электродами и раствором

Для эффективной реализации электролиза водного раствора соли некоторого металла, необходимо обеспечить адекватное снабжение электродами и раствором. В качестве электродов используются обычно металлические пластинки, одну из которых устанавливают на положительном полюсе - аноде, а другую на отрицательном полюсе - катоде.
Катод, на котором происходит выделение металла, должен быть выполнен из материала, способного эффективно проводить электродные реакции. Обычно для этой цели используют металлические пластинки из хорошо проводящих материалов, таких как платина или нержавеющая сталь. Такой катод обеспечивает надежную электродную реакцию и эффективную выделение металла.
Анод в данном случае может быть выполнен из различных материалов, однако важно отметить, что анод не претерпевает электродные реакции в данном процессе. Его основная функция заключается в том, чтобы обеспечить продолжение электрической цепи, поддерживая электролиз водного раствора. Обычно анодом выступает пластинка из инертного материала, такого как карбон или платина-титановый сплав.
Однако, помимо адекватного снабжения электродами, также важно обеспечить достаточное количество раствора для электролиза. Раствор должен содержать достаточное количество соли некоторого металла, чтобы обеспечить выделение 1 моля металла на катоде. При необходимости можно использовать молярные пропорции, чтобы рассчитать необходимое количество соли и воды для приготовления раствора.
Выделение 1 моля металла на катоде: основные факторы и влияние на процесс

Процесс электролиза водного раствора соли некоторого металла на катоде позволяет выделить 1 моль металла. Для успешного проведения этого процесса соблюдение нескольких факторов является критически важным.
Во-первых, важную роль играет концентрация ионов металла в растворе. Чем выше концентрация металлических ионов, тем больше вероятность их осаждения на катоде. При низкой концентрации ионов металла ток необходим для выделения 1 моля металла может быть слишком слабым для эффективной реакции.
Во-вторых, важно правильно выбрать материал катода. Катод должен быть инертным и стабильным, чтобы не принимать участие в химической реакции и не изменять свои свойства. В противном случае, нежелательные побочные реакции между катодом и ионами металла могут произойти, и это может повлиять на эффективность выделения 1 моля металла.
Температура также оказывает влияние на процесс выделения металла на катоде. Обычно при повышении температуры, скорость реакции увеличивается, что означает большее количество металла, выделенного на катоде за определенное время. Однако, высокая температура может также способствовать побочным реакциям, что может снизить эффективность выделения металла.
Таким образом, при проведении электролиза водного раствора соли некоторого металла для выделения 1 моля металла на катоде, необходимо учитывать концентрацию ионов металла в растворе, правильно выбирать материал катода и контролировать температуру процесса. Все эти факторы оказывают влияние на эффективность выделения металла и должны быть учтены для достижения желаемого результата.
Вопрос-ответ

Что такое электролиз водного раствора соли металла?
Электролиз водного раствора соли металла — это процесс, при котором приложенная электрическая сила разлагает раствор на составные части. В данном случае, происходит выделение 1 моля металла на катоде.
Какие металлы могут быть использованы для электролиза водного раствора соли?
Для электролиза водного раствора соли можно использовать различные металлы, такие как натрий, калий, медь, цинк и другие. Выбор металла зависит от реакционных свойств и доступности элементов.
Что нужно для проведения электролиза водного раствора соли металла?
Для проведения электролиза водного раствора соли металла необходимо иметь раствор соли выбранного металла, два электрода (анод и катод), источник постоянного тока, проводящий раствор и соединения для подключения электродов.
В чем состоит принцип действия электролиза водного раствора соли металла?
Принцип действия электролиза водного раствора соли металла основан на проведении электрического тока через раствор соли, что приводит к разложению соединения на ионы. Приложенная электрическая сила заставляет ионы металла перейти к катоду, где происходит их восстановление в виде молекул металла.
Какова роль катода в электролизе водного раствора соли металла?
Катод — это электрод, на котором происходит восстановление ионов металла в виде молекул. В электролизе водного раствора соли металла, на катоде выделяется 1 моль металла.
