Электролиз водного раствора щелочного металла - это процесс, основанный на применении электрического тока для разложения водного раствора щелочного металла на составляющие его ионы. В результате электролиза происходит формирование отрицательно заряженных катионов и положительно заряженных анионов. Эти ионы перемещаются в направлении электрического тока и осаждаются на соответствующих электродах.
Принцип действия электролиза водного раствора щелочного металла основывается на реакциях окисления и восстановления, которые происходят на электродах. При подключении источника постоянного напряжения к электродам, на положительно заряженном аноде происходит окисление ионы воды, а на отрицательно заряженном катоде происходит восстановление ионы воды.
Применение электролиза водного раствора щелочного металла имеет широкий спектр применений. Одним из наиболее известных примеров является получение металлов щелочных металлов, таких как натрий и калий. Электролиз также используется для получения галогенов, таких как хлор и бром, и для производства различных химических соединений.
Электролиз водного раствора щелочного металла является важным процессом в химической промышленности и научных исследованиях. Он позволяет получать ценные химические элементы и соединения, которые являются необходимыми для производства различных продуктов и материалов.
Принцип действия электролиза водного раствора щелочного металла
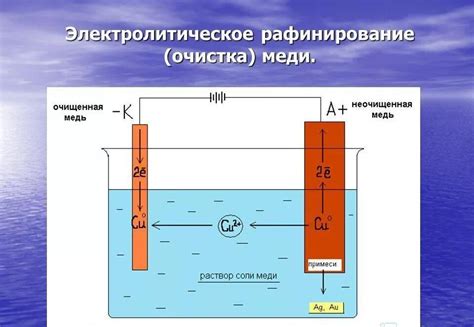
Электролиз водного раствора щелочных металлов основан на применении электрического тока для разложения веществ на ионы и восстановления элементов. Щелочные металлы, такие как натрий или калий, растворяются в воде, образуя ионы гидроксида и металла. При проведении электролиза водного раствора щелочного металла, анодом служит платиновый электрод, а катодом - металлический стержень, который погружен в раствор.
При включении электрического тока через раствор, гидроксидные ионы (OH-) притягиваются к аноду, где они окисляются. В результате окисления, на аноде выделяется кислород, который образует пузырьки на поверхности электрода. В то же время, вода на катоде восстанавливается за счет электрода, образуя водород. Таким образом, электролиз приводит к разделению водного раствора щелочного металла на ионы и его компоненты.
Применение электролиза водного раствора щелочного металла широко распространено в различных областях, включая производство алюминия, натриевой гидроксида (пищевой соды) и других химических соединений щелочных металлов. Этот процесс также используется в электрохимических аккумуляторах и водородных генераторах, где электролиз воды применяется для производства водорода.
Влияние электрического тока на водной раствор щелочного металла

Электролиз водного раствора щелочного металла – это процесс, при котором под действием электрического тока происходит деление воды на отрицательно заряженные ионы водорода и положительно заряженные иони щелочного металла, таких как натрий или калий.
Электрический ток, пропускаемый через раствор щелочного металла, вызывает появление электролитических ячеек. В конце своего пути отрицательно заряженные ионы водорода собираются у катода, а положительно заряженные ионы щелочного металла собираются у анода.
При электролизе водного раствора щелочного металла происходит окисление щелочного металла на аноде и восстановление водорода на катоде. Таким образом, происходит разделение воды на компоненты с образованием молекулярного водорода и ионов щелочного металла.
Такой процесс имеет широкое применение в различных областях. Например, электролиз щелочных металлов используется в производстве алюминия, натрия или калия. Также этот метод применяется для получения водорода для использования в различных химических процессах.
Электролиз водного раствора щелочного металла является важным инстументом в химической промышленности и научных исследованиях. Он позволяет получать реактивные вещества и изучать их свойства, а также использовать их в других процессах и технологиях.
Процесс разложения воды на газы при электролизе щелочного металла
Электролиз водного раствора щелочного металла является процессом, при котором вода разлагается на составляющие ее газы под воздействием электрического тока. Основными щелочными металлами, которые используются в данном процессе, являются натрий и калий.
Процесс электролиза воды осуществляется в электролитической ячейке, в которой находятся два электрода - катод и анод. Катодом обычно выступает объект из железа или платины, а анодом - объект из щелочного металла. Вода разлагается при подаче постоянного тока через электроды.
На катоде происходит образование молекул водорода (H2), а на аноде - образование молекул кислорода (O2). Эти газы отделяются друг от друга и скапливаются в соответствующих отсеках электролитической ячейки.
Применение электролиза водного раствора щелочного металла обладает широким спектром. Один из основных примеров его использования - получение водорода, который находит свое применение в водородных топливных ячейках, в производстве аммиака, а также в различных промышленных процессах.
Также, электролиз щелочных металлов позволяет получать кислород, который может использоваться в медицинских целях, в процессах сварки и резки, а также в химической промышленности.
Применение электролиза водного раствора щелочного металла
Электролиз водного раствора щелочного металла находит широкое применение в различных отраслях промышленности. Например, он используется при производстве щелочи – важного химического вещества, применяемого в производстве стекла, синтетических волокон, моющих и моюще-дезинфицирующих средств, а также водоочистке.
Еще одна важная область применения электролиза водного раствора щелочного металла – получение металлического натрия и калия. Эти элементы широко используются в химической и фармацевтической промышленности, металлургии, электротехнике и других отраслях.
Кроме того, электролиз водного раствора щелочного металла применяется при получении множества важных химических соединений. Например, с помощью него получают пероксид водорода – особо активное и важное вещество, применяемое как в промышленности, так и в медицине и научных исследованиях. Также с помощью электролиза можно получить множество солей щелочных металлов, используемых в различных отраслях.
Значительное применение электролиз водного раствора щелочного металла также находит в аккумуляторных батареях. Электролиз используется при производстве электролита для аккумуляторов – раствора соли щелочного металла, который обеспечивает электрохимическую реакцию внутри батареи и выполняет функцию проводника для ионов.
Производство щелочных металлов и других веществ с использованием электролиза
Электролиз водного раствора щелочного металла - это процесс использования электрического тока для разложения воды на составляющие ее элементы, а именно на водород и кислород. В результате этого процесса возможно получение щелочных металлов и других веществ, таких как хлор и щелочные гидроксиды.
Для проведения электролиза водного раствора щелочного металла необходим специальный электролит, обычно он представляет собой раствор гидроксида щелочного металла. В процессе электролиза положительно заряженная анодная область притягивает отрицательно заряженные гидроксидные ионы, которые окисляются, образуя газовые или твердые продукты, в зависимости от условий проведения реакции.
Электролиз водного раствора щелочного металла широко применяется в промышленности для производства щелочных металлов, таких как натрий и калий. Эти металлы являются важными сырьевыми материалами для производства различных химических соединений, стекла, мыла, дезинфицирующих средств и других продуктов.
Кроме того, электролиз водного раствора щелочного металла также применяется для получения других веществ. Например, при электролизе раствора соли натрия или калия можно получить хлор и кислород, которые могут быть использованы в различных отраслях промышленности, включая производство пластмасс, белизны, отбеливателей и многих других продуктов.
Таким образом, электролиз водного раствора щелочного металла является важным процессом для производства щелочных металлов и других веществ. Этот метод позволяет получить различные продукты, которые широко используются в различных сферах деятельности и имеют большое значение для промышленности и нашей повседневной жизни.
Вопрос-ответ

Как работает электролиз водного раствора щелочного металла?
Электролиз водного раствора щелочного металла основан на процессе электролиза, при котором электрический ток пропускается через раствор, вызывая химические изменения. В случае щелочных металлов, таких как натрий или калий, происходит разложение воды на гидроксид металла (щелочь) и выделение водорода.
Какие применения имеет электролиз водного раствора щелочного металла?
Электролиз водного раствора щелочного металла имеет широкий спектр применений. Он используется в производстве щелочей для различных промышленных и химических процессов, таких как производство мыла, стекла или бумаги. Также этот процесс может быть использован в производстве водорода водородных топливных элементов и синтезе различных органических соединений.
Могут ли щелочные металлы вызывать опасность при проведении электролиза?
Да, при проведении электролиза водного раствора щелочного металла необходимо быть осторожным, так как щелочные металлы обладают высокой реактивностью и могут вызвать ожоги или даже взрывы при контакте с водой. Поэтому необходимо соблюдать меры безопасности, включая использование защитной экипировки и проведение экспериментов под контролем.
Как контролируется электролиз водного раствора щелочного металла?
Электролиз водного раствора щелочного металла контролируется путем регулирования силы тока и времени проведения процесса. Сила тока должна быть достаточной для обеспечения протекания реакции, но при этом не должна превышать безопасные значения. Время проведения электролиза зависит от требуемого количества получаемых продуктов и определяется экспериментатором.
Может ли электролиз водного раствора щелочного металла быть использован в бытовых условиях?
Электролиз водного раствора щелочного металла в бытовых условиях чрезвычайно редко используется из-за сложности и опасности процесса. Это больше подходит для промышленных и научных целей. В бытовых условиях обычно используют другие методы для получения водорода или покупают уже готовые продукты на рынке.
