Электролиз сульфата металла – это процесс, при котором электрический ток применяется для разложения сульфата металла на его составные части – металл и кислород. Этот процесс имеет широкое применение в индустрии, особенно в производстве металлов, таких как медь, цинк, никель и другие.
На катоде, который является отрицательным электродом, происходит основная реакция электролиза сульфата металла. Под воздействием электрического тока, ионы металла из раствора сульфата перемещаются к катоду и вступают в реакцию с электродом. При этом ионы металла получают электроны от катода и превращаются в металлическую форму.
Заметно, что электролиз сульфата металла на катоде сопровождается также выделением водорода. Это происходит из-за того, что на некоторых металлах, таких как медь, водород при потенциалах ниже определенного значения образуется более легко, чем металл. Таким образом, на катоде происходит конкуренция между выделением водорода и осаждением металла, и вода влияет на результат этой конкуренции.
Особенности процесса электролиза сульфата металла на катоде варьируются в зависимости от типа металла и условий проведения электролиза, включая концентрацию раствора, температуру, плотность тока и другие факторы. Правильный контроль этих параметров позволяет оптимизировать производственные процессы и получать металлы с требуемыми характеристиками.
Электролиз сульфата металла: определение и основы процесса

Электролиз сульфата металла - это электрохимический процесс, при котором сульфат металла разлагается на металлический элемент и кислород под воздействием электрического тока. Он является одним из основных методов получения металлов высокой чистоты.
Основная цель электролиза сульфата металла заключается в получении металлического элемента из его соединения. Процесс проводится в электролитической ванне, где металлическое соединение выступает в роли электролита, а анод и катод - в роли электродов.
На катоде происходит обратимая реакция восстановления, при которой металлический ион присоединяется к электроду и образует осадок металла. В случае с электролизом сульфата металла, на катоде образуется металлический элемент, а избыток электронов используется для восстановления воды водородом.
Процесс электролиза сульфата металла может быть сложным и требовать контроля температуры, тока и других параметров. Однако, он является важным методом для получения металлов высокой чистоты и широко применяется в различных промышленных и научных отраслях.
Что такое электролиз сульфата металла?
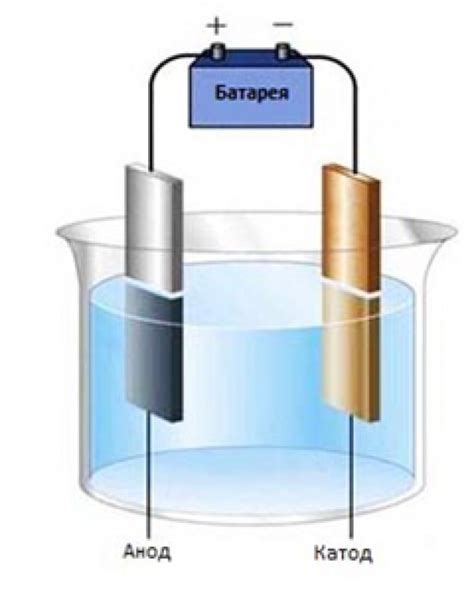
Электролиз сульфата металла является процессом электролитического разложения сульфата металла под воздействием постоянного электрического тока. В ходе данного процесса сульфат металла разлагается на металлический катод и анодную реакцию, что позволяет получить металлический продукт высокой степени чистоты.
В зависимости от типа металла, сульфат металла может быть различным. Например, в случае электролиза сульфата меди на катоде происходит восстановление ионов меди, а на аноде - окисление ионов серы. Таким образом, электролиз сульфата меди позволяет получить высококачественную медь.
Процесс электролиза сульфата металла является важным методом получения металлов и имеет широкое применение в промышленности. Он позволяет добиться высокой степени очистки и управляемости процесса, что особенно ценно при производстве металлических изделий, требующих особой степени чистоты и качества. Кроме того, электролиз сульфата металла может быть использован для восстановления редкоземельных, драгоценных и других ценных металлов из их соединений.
Общая схема электролиза сульфата металла включает в себя использование электролита (сульфата металла), катода и анода, а также внешнего источника постоянного тока. В процессе электролиза сульфата металла на катоде и аноде происходят различные электрохимические реакции, что обеспечивает их разложение и образование соответствующих продуктов.
Основные принципы электролиза сульфата металла
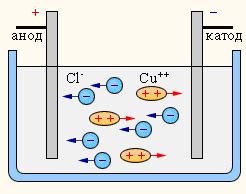
Электролиз сульфата металла является одним из важных процессов в химической промышленности, позволяющим получать металлы высокой чистоты и контролировать их химические свойства. Процесс основан на применении электрического тока для преобразования сульфата металла в металлическую форму на катоде.
При электролизе сульфата металла, на катоде происходит восстановление металла из его ионной формы. Катодом служит проводник, обычно изготовленный из металла, который не является анодом в данной среде. При подаче электрического тока через электролит, между катодом и анодом, происходит движение ионов металла и сульфатных ионов.
На катоде, под действием электрического тока, происходит редукция ионов металла. Ионы металла получают электроны и превращаются в нейтральные атомы металла, которые осаждаются на поверхности катода. Это позволяет получать металл с высокой степенью чистоты и способствует его отделению от электролита.
Подобные процессы электролиза сульфата металла широко используются в промышленности для получения таких металлов, как медь, цинк, никель и другие. Для каждого металла существуют определенные параметры, которые необходимо учитывать при проведении электролиза, такие как температура, концентрация сульфата металла, ток и другие факторы. Все эти параметры влияют на эффективность процесса и качество получаемого металла.
Электропроцессы на катоде во время электролиза сульфата металла

При электролизе сульфата металла на катоде происходят следующие электропроцессы:
- Восстановление металла - на катоде происходит реакция восстановления металла из ионов металла, содержащихся в электролите. Электроны, поступающие через внешнюю цепь на катод, участвуют в реакции ионов металла, приводя их в металлическое состояние. Таким образом, на катоде осаждается металл.
- Выделение водорода - в процессе электролиза сульфата металла на катоде образуется водород, который обычно выделяется в газообразной форме. Образование водорода связано с реакцией восстановления H+ иных гидроксо-комплексных ионов водорода, содержащихся в электролите. Водород выделяется в виде пузырьков на поверхности катода.
- Возможные побочные реакции - при электролизе сульфата металла на катоде могут возникать побочные электрохимические реакции, такие как выделение кислорода или образование гидроксидов металлов. Если на катоде присутствуют другие катионы металлов, то они также могут принимать участие в электрохимических процессах и осаждаются в металлической форме.
Таким образом, на катоде во время электролиза сульфата металла происходят процессы восстановления металла, выделения водорода и возможные побочные реакции. Все эти процессы зависят от сульфата металла, условий проведения электролиза и сопутствующих реакций в электролите.
Электрокаталитические реакции, происходящие на катоде

Электролиз сульфата металла осуществляется в электролитической ванне, где на аноде происходит окисление анионов и выделение кислорода, а на катоде — восстановление катионов металла. На катоде происходят электрокаталитические реакции, которые позволяют получить металл в чистом виде.
Один из важных процессов на катоде — диссоциация ионов металла, которая происходит под влиянием электрического тока. При этом ионы металла присоединяются к поверхности катода и образуют металлическую пленку. Этот процесс осуществляется с участием электрокаталитических реакций, которые продвигают процесс диссоциации ионов металла на катоде.
Другая важная электрокаталитическая реакция на катоде — редукция протонов воды. В результате этой реакции на катоде выделяется водород. Протоны (H+) из электролита присоединяются к поверхности катода, где они получают электроны и превращаются в молекулярный водород (H2). Катализаторами этой реакции являются различные металлы, такие как платина, никель и другие.
Важным аспектом электрокаталитических реакций на катоде является выбор материала, из которого изготовлен катод. Оптимальный материал должен обладать высокой проводимостью, химической стойкостью и каталитической активностью. Кроме того, подходящий катод должен иметь достаточно большую поверхность, чтобы обеспечить эффективное протекание электрокаталитических реакций.
Таким образом, на катоде электролитической ванны при электролизе сульфата металла происходят электрокаталитические реакции, способствующие получению металла в чистом виде. Они включают диссоциацию ионов металла и редукцию протонов воды, которые осуществляются под влиянием электрического тока и катализаторов на поверхности катода.
Особенности образования металлического отложения на катоде
Электролиз сульфата металла является одним из основных методов получения металлических отложений на катоде. При этом процессе на катоде происходит электрохимическое восстановление ионов металла, а за счет изменения потенциала происходит их осаждение в виде металлической пленки.
Одной из особенностей образования металлического отложения на катоде является его неоднородность. В результате этого процесса на поверхности катода может образовываться металлическая пленка различной толщины и структуры. Это может быть объяснено различными скоростями осаждения ионов металла в зависимости от их концентрации в растворе и токовой плотности электролиза.
Еще одной особенностью образования металлического отложения на катоде является его адгезия к поверхности. Эта характеристика определяет качество и прочность металлической пленки. Улучшение адгезии достигается путем предварительной обработки поверхности катода, которая может включать механическую шлифовку, химическую очистку или покрытие специальной промежуточной пленкой.
Также следует отметить, что образование металлического отложения на катоде может сопровождаться различными процессами, такими как поглощение примесей, включение газов или образование пор на поверхности отложения. Влияние этих факторов на качество металлического отложения требует дополнительных исследований и оптимизации процесса электролиза.
Влияние параметров процесса на результаты электролиза сульфата металла

Электролиз сульфата металла является важным процессом в промышленности и науке. Результаты данного процесса могут быть существенно ослаблены или улучшены в зависимости от того, какие параметры участвуют в процессе.
Один из ключевых параметров, оказывающих влияние на результат электролиза сульфата металла, – это температура электролита. При низкой температуре происходит замедление скорости реакции, что может привести к меньшей эффективности процесса. Повышение температуры, наоборот, способствует ускорению реакции электролиза и повышению производительности.
Кроме того, концентрация сульфата металла в электролите также играет важную роль. Повышение концентрации может увеличить эффективность электролиза, так как больше ионов металла будет доступно для окисления на катоде. Однако слишком высокая концентрация может привести к образованию отложений или перенасыщению раствора, что отрицательно скажется на результате процесса.
Еще одним фактором, влияющим на результаты электролиза сульфата металла, является плотность тока. Подходящая плотность тока позволяет достичь оптимальной скорости реакции, обеспечивая при этом минимальные потери энергии и электролита. Слишком низкая или высокая плотность тока может привести к неэффективному использованию электроэнергии и нежелательным побочным эффектам в процессе электролиза.
Таким образом, для достижения оптимальных результатов при электролизе сульфата металла необходимо учитывать и контролировать такие параметры, как температура электролита, концентрация сульфата металла и плотность тока. Это позволит максимально эффективно использовать электролиз как метод получения металлических соединений.
Вопрос-ответ

Какой металл выделяется на катоде при электролизе сульфата металла?
На катоде в процессе электролиза сульфата металла выделяется сам металл, который находится в составе сульфата.
Какие факторы влияют на скорость электролиза сульфата металла на катоде?
Скорость электролиза сульфата металла на катоде зависит от напряжения, температуры раствора, концентрации сульфата и электрической проводимости раствора.
Что происходит на катоде при электролизе сульфата металла?
На катоде происходит редукция положительных ионов металла, содержащихся в сульфате, с образованием чистого металла и отрицательных ионов.
