Электролиз - это процесс получения металла путем электролитического разложения его соединения. Этот метод широко используется в промышленности для производства различных металлических продуктов, таких как алюминий, медь, цинк, никель и другие.
Процесс электролиза основан на использовании электролита - вещества, способного проводить электрический ток. В процессе электролиза, вещество, содержащее искомый металл, подвергается разложению под действием электрического тока. Этот процесс происходит в электролизере, где электролит разделяет анод и катод, через которые пропускается электрический ток.
Приложение электрического тока вызывает окисление металла на аноде и восстановление на катоде. Это приводит к образованию искомого металла на катоде, который затем может быть собран в виде чистого продукта. В процессе электролиза также происходит отделение нежелательных примесей и образование отходов, которые могут быть утилизированы или переработаны.
Электролиз: способ получения металла
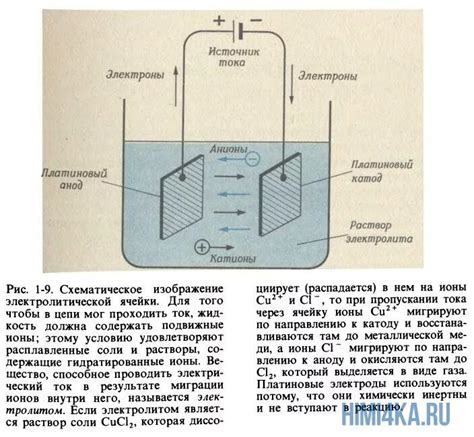
Электролиз является одним из важнейших способов получения металлов. Он основан на электролитическом разложении соединений металлов при прохождении постоянного электрического тока через электролит.
Процесс электролиза проводится в ячейке, которая состоит из двух электродов: анода и катода, а также из электролита. Анод - это положительный электрод, на котором происходит окисление, а катод - отрицательный электрод, на котором происходит восстановление металла.
В процессе электролиза, приложенное напряжение вызывает перемещение ионов металла из электролита на катод. При этом металл образует осаждение на поверхности катода в виде металлической пленки. Таким образом, происходит получение металла в чистом виде.
Выбор электролита для проведения электролиза зависит от свойств металла, который необходимо получить. В качестве электролитов могут использоваться растворы солей металлов или расплавленные соли.
Электролиз является энергоемким процессом и требует достаточно высокого напряжения. Однако, благодаря этому методу можно получить чистый металл без примесей и извлечь его из руды или других источников, что делает электролиз широко используемым способом получения различных металлов.
Принцип электролиза
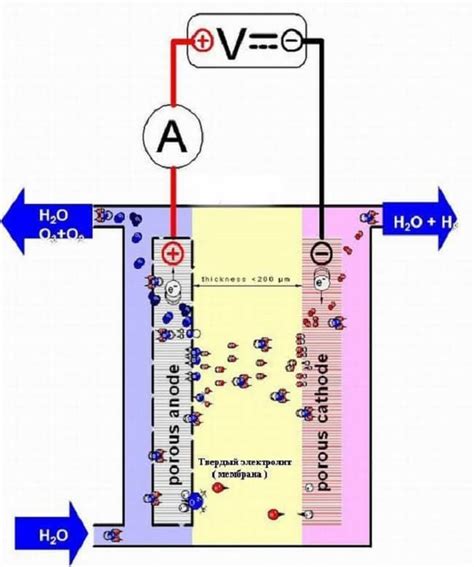
Электролиз - это процесс разложения вещества при помощи электрического тока. Он основан на принципе поглощения или выделения электрических зарядов ионами вещества во время прохождения тока через раствор или плавящееся вещество.
Основными составляющими процесса электролиза являются анод и катод, которые представляют собой электроды, через которые подводится ток. Анод – это положительно заряженный электрод, на котором происходит окисление вещества, а катод – отрицательно заряженный электрод, на котором происходит восстановление вещества.
В качестве проводника при электролизе используется электролит – раствор или плавящееся вещество, которое содержит ионы, способные двигаться под действием электрического поля. Отрицательно заряженные ионы, или анионы, движутся к аноду, где происходит окисление, а положительно заряженные ионы, или катионы, движутся к катоду, где происходит восстановление.
Процесс электролиза можно описать следующим образом: на аноде происходят окислительные реакции, при которых ионы преобразуются в нейтральные атомы или молекулы; на катоде происходят восстановительные реакции, при которых нейтральные атомы или молекулы преобразуются в ионы. Таким образом, происходит разделение вещества на его составные части, которые могут быть использованы, например, для получения чистых металлов или синтеза химических соединений.
Электролитическое разложение вещества
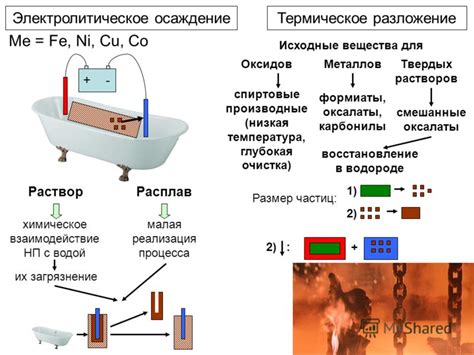
Электролитическое разложение вещества является процессом, при котором под действием электрического тока происходит распад вещества на ионы или атомы. Этот процесс является основой для получения металла методом электролиза.
Для проведения электролиза необходимо наличие электролита - вещества, способного проводить электрический ток. В качестве электролитов могут использоваться растворы солей или кислот, а также расплавы металлов. В процессе электролиза на аноде происходит окисление, а на катоде - восстановление.
В результате электролитического разложения вещества на катоде образуется металл, который осаживается на поверхности электрода. Этот метод получения металла имеет ряд преимуществ, так как позволяет получать чистый продукт высокой степени очистки и контролировать процесс производства.
Для проведения электролитического разложения вещества требуется электролитическая ячейка, состоящая из анода, катода и электролита. Анодом может быть платина, уголь или другой материал, устойчивый к окислению. Катодом обычно служит металлический стержень или пластина, на которую будет осаживаться металл.
Электролитическое разложение вещества широко применяется в различных отраслях промышленности. Например, этот метод используется для получения алюминия, цинка, никеля, меди и других металлов. Также электролиз позволяет выполнять электрохимические депозитные покрытия на поверхности изделий из различных материалов.
Состав электролита

Электролит - это вещество, способное проводить электрический ток в жидкой или расплавленной форме. В процессе электролиза, для получения металла, используется электролит, который должен быть способен разлагаться на ионы. Состав электролита зависит от типа металла, который требуется получить.
Для электролиза растворов солей, в качестве электролита используются растворы солей, таких как хлориды, сульфаты или нитраты. Например, для получения меди используется электролит на основе сульфата меди.
В случае электролиза расплавленных солей, в качестве электролита используются расплавы, содержащие ионы металла, которые требуется получить. Например, для получения алюминия используется электролит на основе расплавленного алюминия и криолита.
Помимо солей, электролитами могут быть также кислоты или щелочи. Например, для электролиза раствора серной кислоты используется кислотный электролит на основе серной кислоты.
Таким образом, состав электролита варьируется в зависимости от желаемого металла и может включать соли, расплавы, кислоты или щелочи.
Реакции электролиза

Электролиз – это способ получения металлов путем электролитического разложения соединений в расплавленных солях или растворах. В процессе электролиза происходят реакции окисления и восстановления веществ.
Во время электролиза положительно заряженные ионы катионы) собираются у катода, а отрицательно заряженные ионы (анионы) – у анода. На катоде происходит реакция восстановления, когда металл осаждается в виде катода или газ выделяется. На аноде происходит реакция окисления, когда анион или другие вещества окисляются, образуя газ или растворимое вещество.
Реакции электролиза могут быть различными в зависимости от раствора или соли, используемых в процессе. Например, при разложении раствора серной кислоты на катоде выделяется водород, а на аноде образуется кислород:
- На катоде: 2H+ + 2e- → H2↑
- На аноде: 4OH- → 2H2O + O2↑ + 4e-
При электролизе раствора хлорида натрия на катоде выделяется натрий, а на аноде образуется хлор:
- На катоде: 2Na+ + 2e- → 2Na↑
- На аноде: 2Cl- → Cl2↑ + 2e-
Реакции электролиза также зависят от концентрации раствора или температуры расплавленных солей. Правильное понимание реакций электролиза позволяет эффективно получать металлы и использовать электролиз в различных отраслях промышленности.
Выбор электрода

При проведении электролиза необходимо выбрать подходящие электроды, которые будут использоваться в процессе разложения электролита.
Одним из факторов, определяющих выбор электрода, является тип разлагаемого вещества. В зависимости от химической природы соединения, необходимо выбрать анод и катод, способные участвовать в соответствующих окислительных и восстановительных реакциях.
Для разложения положительно заряженного иона используют анод, а для отрицательно заряженного - катод.
Анод может быть изготовлен из различных материалов, таких как платина, карбон, сталь, никель и другие. Катод также может быть выполнен из разных материалов в зависимости от целей и требований процесса.
При выборе электродов необходимо учитывать их физические и химические свойства, стойкость к коррозии, плотность тока, а также стоимость и доступность материала.
Применение электролиза в промышленности
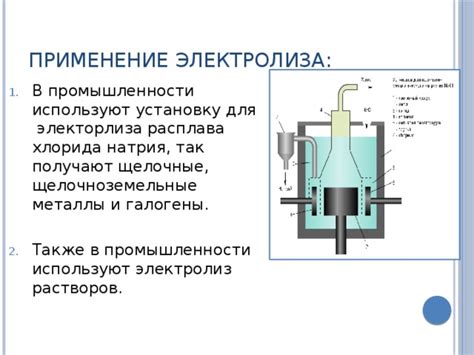
Электролиз является одним из основных методов получения различных металлов в промышленности. Этот процесс основан на электролитическом разложении вещества под воздействием электрического тока. При этом положительно заряженные ионы перемещаются к отрицательно заряженному электроду, образуя металлическое отложение.
Применение электролиза в промышленности позволяет получать широкий спектр металлов, включая алюминий, кобальт, никель, цинк и др. Наиболее распространенным примером использования электролиза является получение алюминия из его руды. Процесс электролиза позволяет получать чистый металл с высокой степенью очистки и контролируемыми свойствами.
Одним из преимуществ электролиза является возможность получения металлов из руд, которые традиционными методами очистки не могут быть использованы. Также, благодаря электролизу, можно получать сплавы с определенными свойствами, которые трудно или невозможно получить при использовании других способов.
Электролиз также широко применяется для получения металлов из отходов промышленности и переработки вторичного сырья. Этот метод позволяет увеличить эффективность использования ресурсов и снизить негативное воздействие производственных отходов на окружающую среду.
В целом, электролиз является важным и перспективным методом получения металлов в промышленности. Он позволяет получать качественные продукты с заданными свойствами, эффективно использовать ресурсы и снижать негативное воздействие на окружающую среду.
Важные факторы электролиза

1. Плотность тока: Ключевым фактором электролиза является плотность тока, то есть количество электрического заряда, проходящего через электролит за единицу времени. Большая плотность тока может привести к увеличению скорости электролиза, однако это может также вызвать повреждение анодов и катодов.
2. Избирательность электролита: Избирательность электролита означает, что разные вещества могут разлагаться на электролитических процессах с разными скоростями. Это связано с различием в электропотенциале разложения разных веществ. Подбор правильного электролита может повысить эффективность электролиза.
3. Температура: Температура также влияет на скорость электролиза. В общем случае, при повышении температуры скорость электролиза увеличивается, однако есть исключения. Например, для электролиза раствора серной кислоты скорость уменьшается с повышением температуры.
4. Концентрация раствора: Концентрация раствора также оказывает влияние на эффективность электролиза. Увеличение концентрации раствора может увеличить скорость разложения вещества.
5. Материал электродов: Материал электродов также важен для эффективного электролиза. Разные материалы могут иметь разную степень проводимости электричества, а также способность к выделению или восстановлению вещества. Например, платина хорошо подходит для электродов, используемых в процессах электролиза.
Вопрос-ответ

Каким образом происходит электролиз?
Электролиз - это процесс, основанный на электролитическом разложении вещества под действием постоянного электрического тока. При электролизе вещество разлагается на ионы в электролите, а затем ионы привлекаются к электродам, где восстанавливаются или окисляются.
Какие металлы можно получить с помощью электролиза?
Электролиз позволяет получать множество металлов, включая алюминий, медь, цинк, никель, свинец и др. Какой металл будет получен зависит от состава электролита и условий проведения процесса.
Какие преимущества и недостатки имеет электролиз?
Электролиз является одним из наиболее эффективных способов получения металлов высокой чистоты. К его преимуществам относятся высокая эффективность, возможность получения редкоземельных металлов, а также возможность влиять на состав и структуру получаемого металла. Однако, электролиз требует внушительных энергетических затрат и специального оборудования, что является его недостатком.
