Электролиз является важным процессом в химии и металлургии, который позволяет выполнять перенос металла с анода на катод с использованием электрического тока. Этот процесс играет ключевую роль во многих индустриальных процессах, таких как производство алюминия, плавка металлов и электрохимическая обработка различных веществ.
В основе электролиза лежит явление электрохимической диссоциации, при которой ионные соединения разлагаются под воздействием электрического тока на ионы положительного и отрицательного заряда. В результате этого процесса, на аноде образуются положительно заряженные ионы, а на катоде - отрицательно заряженные ионы.
Механизм переноса металла с анода на катод основан на принципе электромагнитных сил, действующих на заряды в электрическом поле. При наличии электрического потенциала между анодом и катодом, ионы металла движутся внутри электролита и оседают на поверхности катода в виде металла.
Электролиз является важным инструментом в современной промышленности, позволяющим получать различные металлические продукты с высокой степенью чистоты. Этот процесс также находит применение в производстве различных электрохимических устройств, таких как аккумуляторы, гальванические элементы и электролитические датчики.
Что такое электролиз и как он происходит
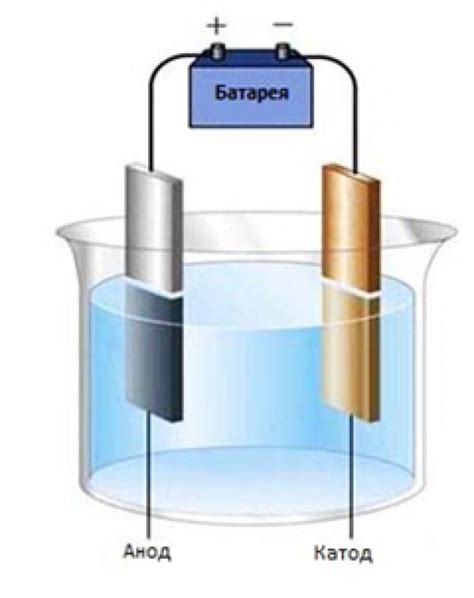
Электролиз - это процесс, при котором с помощью электрического тока происходит перенос металла с анода на катод. Для осуществления электролиза необходимо провести электрический ток через электролит, состоящий из раствора металлического соединения или расплавленного металла.
Основные компоненты системы электролиза - анод, катод и электролит. Анод – это электрод, на котором происходит окисление и образование положительных ионов металла. Катод – электрод, на котором происходит восстановление металла из положительных ионов. Электролит служит проводником для перемещения ионов.
Процесс электролиза осуществляется порциями приложенного напряжения. Под действием электрического поля ионы металла перемещаются к аноду. На аноде происходит образование положительных ионов металла и процесс окисления. Положительные ионы металла движутся через электролит к катоду. На катоде ионы металла восстанавливаются и образуют металлическое соединение или покрытие.
Электролиз широко используется в промышленности, например, для производства алюминия, меди, цинка и других металлов. Это эффективный метод получения металлов с высокой чистотой и стабильными свойствами. Он также находит применение в электрохимическом анализе и процессах покрытия поверхностей металлами.
Процесс электролиза

Электролиз - это процесс переноса металла с анода на катод под действием электрического тока. Он широко применяется в промышленности для получения чистых металлов и сплавов.
Процесс электролиза основан на использовании электролита - раствора или плавящейся смеси ионных соединений металла. Анод и катод погружаются в электролит, и при подаче электрического тока начинается электрохимическая реакция.
На аноде происходит окисление металла, при этом ионы металла переходят в раствор и образуют положительно заряженные ионы (катионы). Эти ионы движутся по направлению к катоду.
На катоде происходит восстановление металла, катионы ионы металла принимают электроны от электрода и встраиваются в металлическую решетку.
В результате процесса электролиза на катоде образуется очищенный металл, который можно использовать в дальнейшем производстве. Анод же медленно теряет массу из-за окисления металла и переноса ионов в раствор.
Процесс электролиза имеет широкий спектр применения, включая производство алюминия, меди, цинка, никеля и других металлов. Он является эффективным и экономически выгодным способом получения высококачественных металлов с нужными свойствами.
Перенос металла с анода на катод
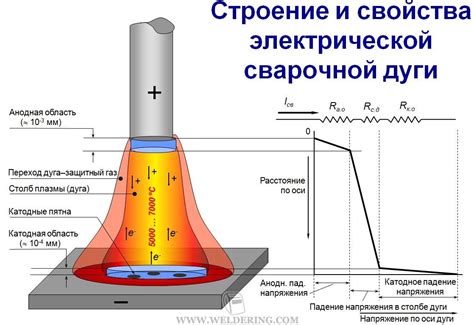
Процесс переноса металла с анода на катод известен как электролиз. Это особый электрохимический процесс, который используется для разделения веществ на составные части. В случае переноса металла, анодом служит металлический предмет или проводник, на котором находится металл, который нужно перенести. Катодом в этом случае служит другой металлический предмет или проводник, на котором осаждаются частицы переносимого металла.
Перенос металла с анода на катод осуществляется через электрическую цепь, в которой находится электролит - вещество, которое обеспечивает проводимость электрического тока и разрушается в результате процесса электролиза. Когда в электрической цепи создается разность потенциалов, идет перенос положительно заряженных ионов металла с анода на катод. На аноде происходит окисление металла и образование положительно заряженных ионов, которые переносятся к катоду.
На катоде, под воздействием силы электрического поля, происходит процесс восстановления металла из положительно заряженных ионов. В результате этого процесса на катоде осаждается металл в виде тонкой пленки или покрытия. Форма и толщина покрытия зависят от условий электролиза, таких как время, температура, концентрация раствора и другие факторы.
Основные применения электролиза

Электролиз, как процесс переноса металла с анода на катод, имеет широкое применение в различных сферах.
Промышленное производство металлов: электролиз используется для получения различных металлов, таких как алюминий, медь, цинк и другие. Он является одним из основных способов производства этих металлов в промышленных масштабах.
Электрохимические процессы: электролиз может использоваться для проведения электрохимических реакций, таких как водородная и кислородная эволюция, получение хлора и щелочей, электрокоагуляция и другие процессы, которые требуют применения электролиза.
Очистка от вредных веществ: электролиз может применяться для очистки воды и сточных вод от различных вредных веществ и загрязнителей. Например, электролиз может использоваться для удаления ионов меди, железа, свинца, цинка и других металлов из водных растворов.
Электродепозиция покрытий: электролиз может использоваться для осаждения металлических покрытий на различных поверхностях. Например, он может использоваться для создания защитных покрытий от коррозии на металлических изделиях или для нанесения декоративных покрытий на ювелирных изделиях.
Электросинтез органических соединений: электролиз может применяться для синтеза органических соединений, таких как алкены, алканы, альдегиды и кетоны. Это позволяет провести реакции, которые сложно осуществить другими методами.
Таким образом, электролиз играет важную роль в различных областях науки и техники, позволяя получать металлы, проводить электрохимические процессы, очищать воду и сточные воды, создавать покрытия и проводить электросинтез органических соединений.
Производство металлов

Производство металлов - это сложный процесс, требующий применения специального оборудования и химических реакций. Одним из основных методов производства металлов является электролиз.
Электролиз - это процесс, при котором металлы переносятся с анода на катод под воздействием электрического тока. В качестве анода обычно используются металлические пластины, а в качестве катода - специальные контейнеры, заполненные раствором соли металла.
Используемый при электролизе электрический ток вызывает химическую реакцию, в результате которой металлы осаждается на катоде. Этот процесс применяется в производстве различных металлов, включая алюминий, кобальт, никель и другие.
Процесс электролиза имеет ряд преимуществ по сравнению с другими методами производства металлов. Во-первых, он позволяет достичь высокой степени чистоты металла. Во-вторых, он позволяет экономить энергию и ресурсы, поскольку металлы могут быть переработаны многократно.
Важно отметить, что процесс электролиза является энергоемким и требует использования большого количества электрической энергии. Однако, благодаря его эффективности и экологической безопасности, он широко применяется в современной промышленности.
Вопрос-ответ

Что такое электролиз?
Электролиз - это процесс переноса металла с анода на катод под воздействием электрического тока, который протекает через электролит.
Какой металл можно получить с помощью электролиза?
С помощью электролиза можно получить различные металлы, такие как алюминий, цинк, никель, медь и др.
Какой принцип лежит в основе электролиза?
В основе электролиза лежат два принципа: анод с положительным зарядом привлекает отрицательно заряженные ионы металла, которые отрываются от анода и перемещаются к катоду, где происходит их осаждение.
Каким образом электролиз используется в промышленности?
Электролиз широко используется в промышленности для производства металлов, покрытий и очистки от примесей. Например, электролиз применяется для производства алюминия, меди и никеля, а также для электропокрытий из золота, серебра и других металлов.
